
dla pacjentów i lekarzy
Chemioterapia - metoda leczenia nowotworów
Spis treści:
1. Wprowadzenie do chemioterapii
1.1 Na czym polega chemioterapia
1.2 Jak działa chemioterapia
1.3 Cele chemioterapii
2. Zależność chemioterapii od fazy cyklu komórek nowotworowych
3. Czynniki wpływające na skuteczność chemioterapii: czas trwania terapii i dobór leków
4. Chemioterapia - czas trwania leczenia
5. Rodzaje chemioterapii
6. Sposoby podawania chemioterapii
7. Powikłania i efekty uboczne chemioterapii
7.1 Nudności i wymioty
7.2 Niedokrwistość
7.3 Neutropenia
7.4 Małopłytkowość
7.5 Utrata włosów
8. Chemioterapia - wskazania do hospitalizacji
Wprowadzenie do chemioterapii
Chemioterapia jako leczenie nowotworów jest bardzo częstą formą terapii. Wokół tej formy leczenia narosło wiele mitów i uprzedzeń, a przecież jest to jeden ze skutecznych sposobów walki z chorobą nowotworową, bez której nie można we współczesnej medycynie wyobrazić sobie nowoczesnego postępowania.
Zależność chemioterapii od fazy cyklu komórek nowotworowych
W chemioterapii stosuje się leki cytostatyczne (cytostatyki), które mają na celu zniszczenie komórek nowotworowych. Leki te stanowią grupę bardzo różnorodną zarówno pod względem pochodzenia jak i sposobu działania. Żeby uszkodzić komórki nowotworowe stosuje się leki, które działają bezpośrednio uszkadzająco bez względu na fazę dzielenia się komórki oraz takie, które działają na komórki w różnych fazach podziału.
Leki przeciwnowotworowe możemy podzielić w zależności od działania na cykl komórkowy na:
- leki działające nieswoiście (działają bez względu na to, czy komórka jest w fazie podziałów (G1,S,G2,) czy fazie spoczynku G0)
- leki działające swoiście dla cyklu komórkowego (działają, gdy komórka jest w dowolnej z faz podziału (G1,S,G2,M), w fazie G0 takie leki są nieaktywne)
- leki działające na poszczególne, konkretne fazy podziału komórkowego (G1 lub S lub G2 lub M)
Do leków działających niezależnie od fazy podziału komórki należą m.in.: cyklofosfamid, ifosfamid, cisplatyna, karboplatyna, oksaliplatyna, dakarbazyna, mitomycyna C. Leki działające na fazy podziału to m.in. metotreksat, 5-fluorouracyl, winblastyna, doksorubicyna, etopozyd, irinotekan, paklitaksel, docetaksel.
Rys. 1. Fazy podziału komórki
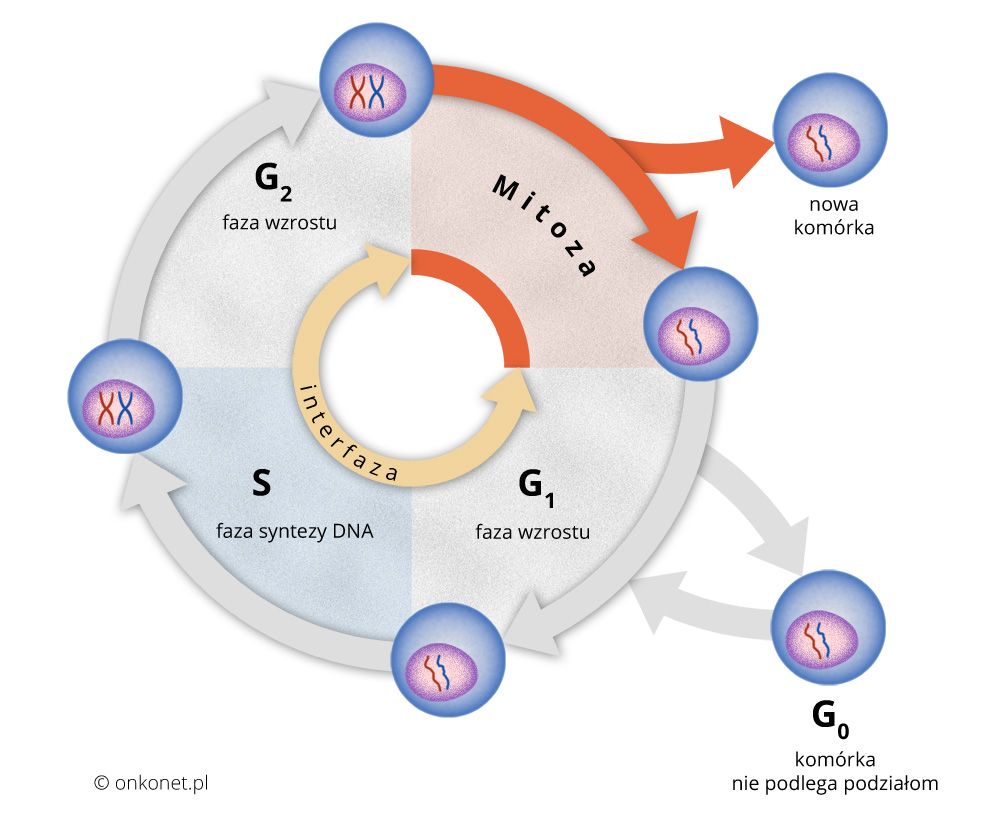
Wyróżniamy następujące fazy cyklu podziału komórkowego:
G1 - fazę wzrostu, S - fazę syntezy DNA, w której zachodzi duplikacja chromosomów, G2 - fazę wzrostu. Fazy G1, S, G2 razem tworzą Interfazę.
M - mitozę (fazę podziału komórki). W mitozie następuje podział komórki, w wyniku czego z jednej komórki powstają dwie.
Z fazy G1 komórka może czasowo lub trwale przejść do fazy G0 w której nie podlega podziałom.
Czynniki wpływające na skuteczność chemioterapii: czas trwania terapii i dobór leków
Leki przeciwnowotworowe często stosuje się dobierając dwa, trzy a nawet więcej leków w odpowiednim dawkowaniu, kolejności i czasie podawania pomiędzy poszczególnymi lekami. Leki działające na różne fazy podziałów komórki są bardziej skuteczne w działaniu skojarzonym. Jednak duże guzy rozwijają się wolniej, zaś większość komórek jest w fazie G0, co wymaga podania leków nieswoistych dla faz cyklu komórkowego. Odstępy czasowe pomiędzy podawaniem leków niezbędne są do odnowy komórek zdrowych, zaś powtarzanie cykli leczenia ma na celu niedopuszczenie do dalszych podziałów komórek nowotworowych.
Skuteczność chemioterapii jest związana z uzyskaniem odpowiedniej ilości leku w komórkach nowotworowych. Znajomość działania poszczególnych leków na różne rodzaje nowotworów, znajomość możliwości dostępu leków z krwi do tkanki nowotworowej warunkuje skuteczność leczenia. Przekładem jest dostępność leków przeciwnowotworowych do jamy otrzewnej, która jest relatywnie niska po podaniu dożylnym i zdecydowanie większa po podaniu dootrzewnowym. Jednak także i w tym przypadku należy wziąć pod uwagę unaczynienie zmian przerzutowych oraz fazowe działanie cytostatyków. Podobnym przykładem jest podawanie leków przeciwnowotworowych bezpośrednio do narządu zajętego przez nowotwór (chemioterapia do tętnicy wątrobowej w przypadku przerzutów do wątroby).
Ważna jest także znajomość dynamiki rozwoju nowotworów, czyli ile komórek jest w fazie wzrostu (frakcja wzrostowa), jak długi jest czas cyklu komórkowego danego rodzaju nowotworu, jaki jest czas podwojenia masy guza. Parametry te są różne nie tylko dla różnych nowotworów, ale także w obrębie jednego typu istnieją różnice.
Przykładowo: dla chłoniaka frakcja komórek w fazie podziału może wynosić powyżej 80%, czas cyklu komórkowego wynosi 2 dni, zaś okres podwojenia masy guza wynosi 30 dni. Z kolei dla raka gruczołowego (np. rak jelita grubego) frakcja komórek w fazie podziału wynosi około 5% - 10%, czas cyklu komórkowego – 3 dni, zaś okres podwojenia masy guza wynosi 200 dni. Te dane mówią nam nie tylko o czasie, w którym nowotwór rozrastał się do wystąpienia objawów (kilka lat dla raka jelita grubego) ale także o dynamice wzrostu oraz przewidywalnej skuteczności chemioterapii po zastosowaniu odpowiednio ułożonych schematów leków przeciwnowotworowych.
Dlaczego w leczeniu systemowym używa się zazwyczaj więcej niż jeden lek przeciwnowotworowy?
Terapia z wykorzystaniem leków przeciwnowotworowych jest prowadzona tak, żeby była jak najbardziej skuteczna. W tym celu stosuje się leki, które są skuteczne w różnych fazach podziału komórki lub wzajemnie zwiększają swoje działanie (działają synergistycznie lub addytywnie).
Do schematów chemioterapii są dobierane takie leki, które mają działanie przeciwnowotworowe w danym typie nowotworu (tzn. stosowane pojedynczo – w monoterapii – mają potwierdzone w badaniach działanie przeciwnowotworowe). Ponadto stosowanie schematów wielolekowych ogranicza prawdopodobieństwo wystąpienia oporności komórek nowotworowych na zastosowany lek (tzn. ogranicza powstanie klonów komórkowych opornych na dany lek).
Dlaczego chemioterapię stosuje się więcej niż jeden raz?
Ze względu na działanie leków przeciwnowotworowych swoistych fazowo (tzn. działających tylko w określonej fazie cyklu komórkowego), polegające na niszczeniu komórek nowotworowych znajdujących się w tylko konkretnej fazie rozwoju, niemożliwe jest ich działanie na komórki nowotworowe znajdujące się akurat w innej fazie. Z tego względu należy chemioterapię powtarzać, tak aby lek mógł zadziałać na komórki, które wcześniej znajdowały się w innej, niepodatnej na lek, fazie rozwoju.
Z kolei w przypadku leków nieswoistych fazowo (tzn. działających niezależnie od fazy, w której znajdują się komórki nowotworowe) skuteczność ich działania jest zależny od dawki: im większa dawka leku, tym większy efekt przeciwnowotworowy. Ograniczeniem jest jednak występowanie objawów niepożądanych (czyli powikłań związanych z chemioterapią) tym częstszych i bardziej poważnych, im większa dawka. Z tego względu ustalona dawka jest kompromisem pomiędzy siłą odziaływania, a powikłaniami. Stosowanie powtarzanych cykli podawania leków pozwala ograniczyć skutki uboczne, utrzymując przy tym skuteczność odziaływania na komórki nowotworowe.
W celu zwiększenia siły działania chemioterapii stosuje się czasami, w uzasadnionych przypadkach, podawanie większej ilości leków lub skraca się czas pomiędzy cyklami ich podawania - jest to nazwane intensyfikacją chemioterapii. Należy jednak zwrócić szczególną uwagę na zwiększoną możliwość wystąpienia powikłań związanych z takim intensywnym leczeniem.
Dlaczego w terapii nowotworów zmienia się schematy chemioterapii w trakcie leczenia?
Leczenie systemowe, w tym i chemioterapia, opiera się na danych z badań naukowych i obserwacji klinicznych pozwalających ustalić, które leki są najbardziej skuteczne jako leczenie (chemioterapia pierwszego rzutu). Gdy jest ono skuteczne w przypadku danego pacjenta, czyli gdy uzyskuje się spodziewaną odpowiedź na leczenie, uzyskuje się remisję (cofanie się) choroby lub stabilizację (zahamowanie choroby), to schemat jest stosowany według ustalonego planu.
Gdy zastosowana chemioterapia pierwszego rzutu okazuje się nieskuteczna, czyli gdy pomimo podania leków dochodzi do rozwoju procesu chorobowego (progresja choroby) nieskuteczne leki zamienia się na inne (chemioterapia drugiego rzutu). Gdy i te nie wykazują spodziewanego efektu stosuje się następne (chemioterapii III-go, IV-go rzutu).
Chemioterapia - czas trwania leczenia
Leczenie systemowe (chemioterapia) oparte o podawanie leków przeciwnowotworowych obejmuje zazwyczaj kilka (3-6) cykli, ale możliwe jest stosowanie chemioterapii także przez dłuższy czas (na przykład 12 cykli). Cyklem leczenia określa się zaplanowaną sekwencję podawania leków rozciągniętą w czasie najczęściej 2 do 4 tygodni. Łącznie czas przyjmowania leków cytostatycznych w chemioterapii może trwać nawet kilka miesięcy. W przypadku leczenia podtrzymującego remisję (zmniejszenie masy guza) chemioterapię stosuje się do czasu progresji (ponownego zwiększenia masy guza).
Przykładowy schemat chemioterapii - FOLFOX stosowany m.in. w leczeniu raka jelita grubego wygląda następująco:
Dzień 1 - Oksaliplatyna
Dzień 1 i 2 - Folinian wapniowy
Dzień 1 i 2 - Fluorouracyl
Długość jednego cyklu wynosi 2 tygodnie
Rodzaje chemioterapii
Ze względu na sposób umiejscowienia w procesie leczenia wyróżniamy następujące rodzaje chemioterapii:
- chemioterapia indukcyjna – chemioterapia mająca na celu zmniejszenie masy guza i umożliwienie poźniej leczenia miejscowego w postaci operacji chirurgicznej lub radioterapii.
- chemioterapia adjuwantowa (uzupełniająca) – chemioterapia jako leczenie uzupełniające po wcześniejszym leczeniu miejscowym (chirurgicznym), w celu uzyskania lepszego efektu leczniczego zarówno pod względem ewentualnej wznowy miejscowej nowotworu jak i wpływu na przeżycie odległe.
- chemioterapia neoadjuwantowa – chemioterapia jako leczenie systemowe zastosowane przed leczeniem miejscowym (tzn. najpierw chemioterapia a następnie zabieg operacyjny lub radioterapia).
- chemioterapia synchroniczna – zastosowanie leków cytotoksycznych w tym samym czasie co radioterapia, w celu uzyskania jak najlepszej odpowiedzi na leczenie. Niektóre leki cytostatyczne mają działanie „fotouczulające” – zmniejszają możliwości naprawcze komórek nowotworowych i czynią je bardziej podatnymi na radioterapię.
- chemioterapia dokanałowa – ze względu na istnienie swoistej bariery krew-mózg, większość leków podanych dożylnie nie przechodzi do ośrodkowego układu nerwowego. W celu umożliwienie dotarcia cytostatyków do układu nerwowego podaje się je do kanału kręgowego, skąd mogą oddziaływać zarówno na guzy umiejscowione w mózgu jak i w rdzeniu przedłużonym i rdzeniu kręgowym.
- chemioterapia dojamowa – leczenie polega na podaniu leków przeciwnowotworowych bezpośrednio do jam ciała (jama brzuszna, jama opłucnowa). Ten sposób podania ma na celu uzyskanie jak największego stężenia leku w miejscu występowania nowotworu (np. rak jajnika, przerzuty raka jelita grubego lub żołądka do otrzewnej, przerzuty nowotworu do opłucnej).
- chemioterapia paliatywna
Sposoby podawania chemioterapii
W zależności od spodziewanego efektu i oczekiwanego stężenia leków przeciwnowotworowych leki przeciwnowotworowe mogą być podawane w następujący sposób:
- dożylnie
- doustnie
- dotętniczo
- dootrzewnowo
- dokanałowo (do płynu mózgowo-rdzeniowego)
- doguzowo
Dożylna droga podania jest najczęstszą w leczeniu nowotworów. Polega na założeniu kaniuli (wenflon) do żyły obwodowej (np. na kończynie górnej). Bardzo często, szczególnie w warunkach szpitalnych, leki przeciwnowotworowe podaje się przez cewniki zakładane do naczyń centralnych (np. do żyły szyjnej wewnętrznej). Coraz częściej stosowane jest podawanie chemioterapii do przez wszczepiane podskórnie porty naczyniowe, które zakłada się do dużych naczyń żylnych, zaś zbiornik, poprzez który podaje się leki, jest umieszczony pod skórą. Jest to wygodna dla pacjenta forma podawania leków dożylnie, a poza tym poprzez podskórne porty naczyniowe możliwe jest podawanie nie tylko innych leków ale także preparatów do żywienia pozajelitowego.
Port dożylny - alternatywa do standardowego dożylnego podawania leków
W celu uniknięcia konieczności wielokrotnych nakłuć żył obwodowych (m.in. na kończynach) w trakcie chemioterapii, u niektórych pacjentów można zastosować jeden syntetyczny przewód umieszczony głęboko w dużej żyle, który posiada wyprowadzony powierzchownie element z możliwością łatwego, wielokrotnego wykonywania wkłuć. » czytaj cały artykuł
Doustna droga podawania jest wygodniejsza dla pacjenta, jednak liczba leków przeciwnowotworowych, które można podawać tą drogą jest ograniczona. Doustne hormonalne leki przeciwnowotworowe stosuje się w leczeniu hormono-zależnego raka piersi. Ta forma podawania leków jest wykorzystywana bardzo często w leczeniu paliatywnym, ale także jest stosowana w skojarzeniu z cytostatykami podawanymi dożylnie.
Dotętnicza droga podania jest wykorzystywana w przypadku, gdy zalecane jest uzyskanie wysokiego stężenia cytostatyków w narządzie zajętym przez guz nowotworowy, zarówno pierwotny jak i przerzutowy. Często podanie leków przeciwnowotworowych tą drogą łączone jest z zamknięciem światła naczynia tętniczego, co doprowadza do niedokrwienia i martwicy guza nowotworowego (t.zw. chemoembolizacja). Stosuje się m.in. w leczeniu nieoperacyjnych przerzutów do wątroby lub nieoperacyjnego raka nerki. Inną metodą stosowaną w leczeniu nowotworów zaawansowanych miejscowo na kończynach (np. przerzuty in-transit czerniaka, mięsaki tkanek miękkich umiejscowione okołostawowo) opartą o podawanie leków dotętniczo jest izolowana dotętnicza chemioterapia kończynowa w hipertermii (ILP – intra-limb perfusion).
Dootrzewnowe podanie leków nowotworowych jest często stosowane w leczeniu raka jajnika z przerzutami do otrzewnej (wlewy dootrzewnowe). Dootrzewnowe podanie leków w sposób ciągły w podwyższonej temperaturze (HIPEC – Hyperthermic Intraperitoneal Chemotherapy) jest specjalistycznym zabiegiem wykonywanym po chirurgicznym usunięciu makroskopowych zmian nowotworowych w jamie otrzewnej w takich nowotworach jak rak jelita grubego, rak jajnika, międzybłoniak otrzewnej, śluzak rzekomy otrzewnej, rak żołądka). Jako leczenie paliatywne dootrzewnowa forma podawania leków pod ciśnieniem jest stosowana nieoperacyjnych nowotworach pierwotnych i wtórnych otrzewnej (PIPAC - Pressurized IntraPeritoneal Aerosol Chemotherapy - czyli Dootrzewnowa Podciśnieniowa Chemioterapia Areozolem). Dootrzewnowe podanie leków cytostatycznych pozwala na uzyskanie zdecydowanie większego stężenia leków aniżeli po podaniu dożylnym ze względu na barierę krew/otrzewna, która ogranicza penetrację cytostatyków do jamy otrzewnej.
Dokanałowy sposób podawania leków przeciwnowotworowych bezpośrednio do płynu mózgowo-rdzeniowego jest wykorzystywany w przypadku nowotwór ośrodkowego układu nerwowego oraz nowotworów rdzenia kręgowego. Dożylne podanie leków cytostatycznych pozwala na uzyskanie zdecydowanie większego stężenia leków aniżeli po podaniu dożylnym ze względu na barierę krew/mózg, która ogranicza penetrację cytostatyków do tkanki nerwowej. Dokanałowe podanie leków odbywa się poprzez cewnik zakładany kanału kręgowego (podobnie jak przy znieczuleniu do rdzenia kręgowego stosowanego w zabiegach operacyjnych).
Doguzowe podawanie leków jest rzadko stosowane. Zazwyczaj tę formę stosowania leków przeciwnowotworowych stosuje się w ramach kontrolowanych badań klinicznych w przypadku nieoperacyjnych guzów skóry i tkanki podskórnej (np. liczne przerzuty czerniaka).
Powikłania w leczeniu lekami cytotoksycznymi
Leki cytotoksyczne działają uszkadzająco na komórki szybko dzielące się, jakimi są komórki nowotworowe. Jednak i zdrowe komórki organizmu narażone są na uszkadzające działanie leków cytotoksycznych. Dotyczy to głównie szybko dzielących się, zdrowych komórek, jakimi są np. komórki szpiku. Ich uszkodzenie czyli mielosupresja może skutkować – zmniejszeniem ilości krwinek białych (neutropenia), zmniejszeniem ilości płytek krwi (trombocytopenia), niedokrwistością, zmniejszeniem ilości krwinek czerwonych (erytropenia).
Niektóre leki cytostatyczne mogą doprowadzić do uszkodzenia nerek (neurotoksyczność), wątroby (hepatotoksyczność), mięśnia sercowego (kardiotoksyczność). Działanie toksyczne na śluzówkę jelit i żołądka może doprowadzić do biegunek, bólów w obrębie jamy brzusznej. Działanie toksyczne ogólnoustrojowe powoduje wystąpienie nudności i wymiotów. Do innych skutków ubocznych stosowania cytotoksycznych leków przeciwnowotworowych należą m.in. zmiany skórne, wypadanie włosów, odczyny uczuleniowe (odczyny anafilaktyczne).
Powikłania związane z chemioterapią mogą wystąpić w różnych okresach. Z tego względu wyróżnia się:
- powikłania wczesne (występują w trakcie stosowania, jak nudności, wymioty, odczyny uczuleniowe lub w krótkim okresie po jej zastosowaniu, jak uszkodzenie komórek szpiku oraz wypadanie włosów)
- powikłania późne (występują nawet do kilku miesięcy po chemioterapii: uszkodzenie mięśnia sercowego, zwłóknienie płuc, uszkodzenie nerek, powikłania neurologiczne)
Powikłania chemioterapii - nudności i wymioty
Nudności i wymioty towarzyszące terapii cytostatykami to skutek uszkadzania komórek enterochromatofilnych żołądka i jelit. Ich wrażliwość bierze się z faktu szybkich podziałów- jak już wspomniano komórka mająca zdolność proliferacyjną, tak jak i komórka nowotworowa, jest szczególnie podatna na niszczący wpływ cytostatyku. Z komórek enterochromatofilnych uwalniana jest serotonina. Jest to oligopeptyd, który pobudzając swoje własne receptory prowadzi do pobudzenia włókien nerwowych a w efekcie do wystąpienia nudności i wymiotów. Poza tym chemioterapeutyki bezpośrednio drażnią receptory w OUN (Ośrodkowy Układ Nerwowy), pobudzając ośrodek wymiotny w rdzeniu przedłużonym przez krew lub płyn mózgowo-rdzeniowy.
Wymioty ostre, wczesne, występujące w ciągu pierwszych 24 godzin po podaniu cyklu chemioterapii. Ich mechanizm jest dość jasny, dotyczą większości pacjentów, szczególnie poddawanych leczeniu przy użyciu schematów zawierających pochodne platyny (cisplatyna, oksaliplatyna, karboplatyna). Według kryteriów CTCAE (Common Terminology Criteria for Adverse Events) wymioty wywołane przez chemioterapię można podzielić na:
- wymioty ostre, nasilające się po ok. 5 godzinach od podania leków
- wymioty opóźnione, pojawiające się po ponad 24 godzinach od podania leków lub pojawiające się po 5-7 dniach od podania
- wymioty „przebijające”, występują w różnym czasie, także pomimo stosowania leków przeciwwymiotnych
- wymioty „oporne”, występują uporczywie w kolejnych cyklach chemioterapii, są oporne na leczenie przeciwwymiotne
Ze względu na różne nasilenie działania wymiotnego leki przeciwnowotworowe podzielono na 4 grupy:
- Leki wywołujące wymioty > 90% (cisplatyna, cyklofosfamid w wysokich dawkach, dakarbazyna, karmustyna)
- Leki wywołujące wymioty w 30% - 90% (oksaliplatyna, cyklofosfamid, karboplatyna, doksorubicyna, irinotekam, ifosfamid)
- Leki wywołujące wymioty w 10% - 30% (paklitaksel, docetaksel, topotekan, etopozyd, pemetreksed, metotreksat, mitomycyna C., gemcytabina, 5-FU, cetuksymab. Trastuzumab, panitumumab)
- Leki wywołujące wymioty < 10% (becyzumab, winkrystyna, winblastyna, bleomycyna)
Znajomość działania wymiotnego stosowanych leków przeciwnowotworowych, szczególnie w sytuacji podawania schematów wielolekowych, umożliwia zastosowanie odpowiednich leków przeciwwymiotnych przed chemioterapią oraz w okresie po podaniu leków. Poza tym pomaga przewidzieć okresy, w którym pacjent będzie miał zwiększone problemy z przyjmowaniem pokarmów i odpowiednio wcześniej przeciwdziałać takiej sytuacji poprzez np. zastosowanie wspomagania żywieniowego w okresie bez występowania wymiotów.
Leki przeciwwymiotne o największym wskaźniku terapeutycznym to antagoniści receptora serotoninowego i kortykosteroidy. Obie klasy są bardzo skuteczne a przy odpowiednim dawkowaniu wywołują niewiele istotnych skutków ubocznych. W razie wskazań i szczególnie nasilonych objawów, można je bezpiecznie łączyć.
Leki z grupy antagonistów serotoninowych: ondansetron, dolasetron, granisetron, i tropisetron - działając na receptor serotoninowy 5-HT3, skutecznie tłumią wymioty wczesne. Przy swojej wysokiej skuteczności są bezpieczne, powodują nieliczne skutki uboczne i, w zależności od kondycji pacjenta, mogą być podawane różnymi drogami. W przypadku niedostatecznej skuteczności możemy bez przeszkód dołączyć kortykosteroidy- również skutecznie przeciwdziałają wymiotom wywołanym chemioterapią. Takie kojarzenie lekowe jest szczególnie pomocne u chorych, w stosunku do których stosujemy najagresywniejsze schematy leczenia, związane z dużym ryzykiem wymiotów (oparte na pochodnych platyny (cisplatyna) a także cyklofosfamid w większych dawkach czy dakarbazyna). Oba leki warto zastosować w dawce jednorazowej, przed podaniem cyklu chemii gdyż ich skuteczność jest wtedy największa a w pojedynczych dawkach rzadko powodują skutki niepożądane.
Istnieje kilka innych grup leków przeciwwymiotnych, również stosowanych wspomagająco w terapii nowotworowej. Są one po pierwsze mniej skuteczne od antagonistów receptora serotoninowego i kortykosteroidów, a po drugie powodują więcej skutków niepożądanych z powodu mniejszej wybiórczości działania.
Antagoniści receptora serotoninowego często stosowane są po wystąpieniu reakcji wymiotnej, natomiast nie zapobiegawczo. Inne leki: haloperidol i droperidol, oraz fenotiazyny (prochlorperazyna i tietylperazyna) nie są tak chętnie stosowane ze względu na mniejszą skuteczność i większe niebezpieczeństwo objawów niepożądanych, zwłaszcza u chorych w starszym wieku. Należy zaznaczyć jak ważna jest obserwacja pacjenta. Nie każdy bowiem reaguje gwałtownie na podanie cytostatyku, a poza tym nudności i wymioty mogą być skutkiem innej patologii, o czym również nie powinno się zapominać. Tych pacjentów, dla których reakcje wymiotne są szczególnie uciążliwe, należy profilaktycznie zabezpieczyć farmakologicznie przed rozpoczęciem terapii by móc załagodzić jej skutki i nie powodować psychicznej niechęci do kontynuacji leczenia.
Powikłania chemioterapii - niedokrwistość
Terminem „niedokrwistość” określa się obserwowane zmniejszenie poniżej wartości uznanych za normę parametrów krwi: liczba krwinek czerwonych (erytrocyty, Erys), hemoglobina (Hb), hematokryt (Hct). Objawy niedokrwistości w chorobie nowotworowej są związane z samą chorobą (krwawienie z guza nowotworowego, przerzuty do szpiku) a także z leczeniem (uszkodzenie szpiku spowodowane lekami przeciwnowotworowymi w wyniku chemioterapii).
Omawiając powikłania związane z występowaniem niedokrwistości należy pamiętać o roli krwinek czerwonych: dostarczanie tlenu do tkanek całego organizmy. Upośledzenie tej funkcji występuje gdy brak jest nośnika dla tlenu (zmniejszenie liczby erytrocytów z powodu krwawienia lub uszkodzenia szpiku) lub gdy dochodzi do spadku przepływu krwi z powodu braku odpowiedniej ilości płynów (odwodnienie spowodowane masywnymi wymiotami lub biegunkami lub znaczące krwawienie).
Objawami niedokrwistości spowodowanej zmniejszeniem ilości czerwonych krwinek są m.in. zmęczenie, zaburzenia snu, duszność wysiłkowa, bóle głowy, zaburzenia rytmu serca, tachykardia (przyspieszenie akcji serca). Pacjenci z chorobami przewlekłymi (choroby serca, choroby płuc) zgłaszają nasilenie objawów. Niedokrwistość wpływa ponadto na obniżenie funkcji układu immunologicznego, co w leczeniu chorób nowotworowych ma bardzo duże znaczenie.
Do leków przeciwnowotworowych, które mają działanie uszkadzające szpik i powodują objawy niedokrwistości należą m.in.: busulfan, doksorubicyna, cisplatyna, cyklofosfamid, 5-Fluorouracyl, gemcytabina, metotreksat, melfalan, epirubicyna, winblastyna, etopozyd,topotekan.
Istotą niedokrwistości jest zaburzenie hematopoezy (tworzenia krwinek czerwonych) będące wynikiem uszkodzenia szpiku przez chemioterapie lub radioterapię oraz będącą następstwem rozwijającej się choroby nowotworowej. (Niedokrwistość towarzysząca chorobom nowotworowym). Ta ostatnia występuje nawet u około 40% chorych na nowotwory.
Określenie przyczyny niedokrwistości jest niezwykle ważne dla podjęcia decyzji o sposobie jej leczenia:
- w przypadku krwawienia z guza leczeniem z wyboru jest przetoczenie preparatów krwi
- w przypadku niedokrwistości towarzyszącej chorobie nowotworowej jedną z najczęstszych przyczyn jest zmniejszenie syntezy (wytwarzania) erytropoetyny. Leczenie polega na podawaniu leków zwiększających syntezę erytropoetyny, erytropoetynę oraz preparatów żelaza.
Niedokrwistość spowodowana lekami przeciwnowotworowymi wymaga podawania leków zwiększających syntezę erytropoetyny. Należy przy tym pamiętać, że erytropoetyna zwiększa krzepliwość krwi i może być przyczyną powikłań zatorowo-zakrzepowych. W związku z tym należy stosować ją ostrożnie, szczególnie u osób starszych i z chorobami sercowo-naczyniowymi.
Erytropoetyny nie powinno stosować się u chorych z nowotworami z niedokrwistością spowodowaną innymi niż chemioterapia przyczynami ze względu na możliwe pogorszenie wyników leczenia
W przypadki niedokrwistości na poziomie hemoglobiny < 7g / dl wskazane jest przetaczanie preparatów krwi, gdyż jest to sytuacja zagrażająca życiu.
Powikłania chemioterapii - neutropenia
Neutropenia to zmniejszenie liczby granulocytów obojętnochłonnych (krwinek białych) we krwi poniżej 1,5x109/L. Jest częstym następstwem stosowania w chemioterapii leków przeciwnowotworowych uszkadzających szpik (działanie mielosupresyjne). Leki przeciwnowotworowe działają na komórki szybko dzielące się, jakimi są komórki nowotworowe, ale tak funkcjonują także komórki szpiku, w związku z czym są narażone na uszkodzenie.
Nasilenie działania uszkadzającego szpik jest związane z wielkością dawki leku cytostatycznego. Większość tych leków powoduje odwracalne działanie uszkadzające komórki, trwające 1-2 tygodnie. Z tego powodu w trakcie cyklu chemioterapii uwzględnia się ten okres, zaś następne podanie leków odbywa się 2-3 tygodnie od poprzedniego. Najniższy poziom granulocytów w trakcie stosowania chemioterapii określa się mianem nadir.
Niektóre leki powodują uszkodzenie komórek szpiku w późniejszym czasie (np. busulfan, melfalan) i należy wziąć to pod uwagę przy planowaniu całego leczenia.
Neutropenia może być stanem zagrażającym życiu ze względu na możliwe znaczne obniżenie odporności i w pojawiające się związku z tym ryzyko powikłań infekcyjnych, włącznie z sepsą.
Z tego powodu przed każdym podaniem następnego cyklu chemioterapii wykonuje się badanie parametrów krwi, na podstawie którego ocenia się wielkość neutropenii (liczba granulocytów obojętnochłonnych):
I° – 2,0x109/L do 1,5x109/L (ryzyko zakażeń nie zwiększone)
II° - 1,5x109/L do 1,0x109/L (ryzyko zakażeń małe)
III° - 1,0x109/L do 0,5x109/L (ryzyko zakażeń średnie)
IV° – < 0,5x109/L (ryzyko zakażeń duże)
Należy także pamiętać, że ryzyko zakażeń zwiększa się jeśli neutropenia trwa dłuższy czas. Największe prawdopodobieństwo wystąpienia zakażeń jest w przypadku IV° neutropenii trwającej więcej 7 dni.
Najczęściej pierwszym objawem powikłań infekcyjnych jest podwyższona temperatura powyżej 38°C.
Jeśli gorączka występuje w IV° neutropenii lub w III° ale przewiduje się dalszy spadek liczby granulocytów w ciągu 48 godzin to gorączka ta nosi nazwę gorączki neutropenicznej. Gorączka neutropeniczna jest rozpoznawana także przy klinicznych objawach posocznicy (sepsa).
Chorzy, u których doszło w wyniku chemioterapii do neutropenii powinni przestrzegać zasad higieny osobistej, unikać kontaktu z innymi osobami (choroby dróg oddechowych i inne), spożywać pokarmy wolne od drobnoustrojów (gotowane).
Ważne: przed planowaną chemioterapią powinny być wyleczone wszelkie stany zapalne u chorego (m.in. choroby zębów, odleżyny, choroby zapalne dróg oddechowych, moczowych). Mogą być one źródłem bakterii powodujących posocznicę w przypadku neutropenii. Z tego też powodu chorzy mający niewyleczone stany zapalne nie mogą być kwalifikowani do chemioterapii.
Postępowanie lecznicze w przypadku neutropenii zagrażającej powikłaniami infekcyjnymi i gorączką neutropeniczną
Lekami stosowanymi w profilaktyce powikłań neutropenii są czynniki stymulujące wzrost granulocytów w szpiku (G-CSF ang. granulocyte-colony stimulating factor). Rozważenie podania tych leków należy dokonać w przypadku leków przeciwnowotworowych stosowanych w monoterapii lub w schematach wielolekowych gdy znane jest ryzyko wystąpienia gorączki neutropenicznej powyżej 20%. Dodatkowymi czynnikami podejmowanymi przy decyzji o zastosowaniu leków G-CSF jest starszy wiek chorych, zaawansowana choroba nowotworowa i brak stosowania antybiotyków w okresie neutropenii.
Według zaleceń towarzystw naukowych czynniki stymulujące wzrost granulocytów powinny być podane 24-72 godzin po zakończeniu chemioterapii i stosowane do uzyskania trwałego wzrostu granulocytów.
Powikłania chemioterapii - małopłytkowość (trombocytopenia)
Małopłytkowość to zmniejszenie liczby pytek krwi poniżej 150x109/L. Występuje u około 10%-30% chorych z nowotworami litymi (czyli tworzącymi masy nowotworowe – „guzy”) i u około 75% chorych z nowotworami hematologicznymi (nowotworami krwi). Przyczyna małopłytkowości w trakcie chemioterapii jest podobna jak w niedokrwistości i neutropenii – uszkodzenie szpiku przez leki przeciwnowotworowe. Małopłytkowość nasilona jest w chorobach wątroby (marskość), przy niedoborze witaminy B12 (np. po resekcji żołądka), przy chorobach śledziony (splenomagalia), w chorobach immunologicznych w których dochodzi do niszczenia płytek krwi.
W małopłytkowości wyróżnia się stopnie:
I° – Liczba płytek krwi wynosi 75 – 150 x 109/L
II° – Liczba płytek krwi wynosi 50 – 75 x 109/L
III° – Liczba płytek krwi wynosi 25 – 50 x 109/L
VI° – Liczba płytek krwi wynosi < 25 x 109/L
Podstawowym i najważniejszym powikłaniem małopłytkowości jest ryzyko krwawienia. Im mniejsza ilość płytek krwi, tym prawdopodobieństwo krwawienia większe. Jeśli ilość płytek krwi jest mniejsza niż 20 x 109/L, to ryzyko krwawienia jest wysokie. Jeśli obniży się do mniej niż 5 x 109/L to może wystąpić krwawienie zagrażające życiu. Ryzyko krwawienia zwiększa się jeśli z małopłytkowością współistnieje gorączka, zakażenia lub pacjent przyjmuje leki obniżające krzepliwość krwi.
Obniżenie ilości płytek krwi do mniej niż 50 x 109/L przy jednoczesnym wystąpieniu objawów skazy krwotocznej (objawy wskazujące na krwawienie) jest wskazaniem do przetoczenia preparatów zawierających skoncentrowane płytki krwi (koncentrat krwinek płytkowych - KKP). Obniżenie płytek krwi do tego poziomu u chorych wymagających leczenia operacyjnego także wymaga przetoczenia KKP.
Klasyfikacja WHO nasilenia krwawienia:
- 0° – brak krwawienia
- I° – wybroczyny i krwawienia w śluzówkach, wymagające przetoczenia KKP lub krwawienia do siatkówki bez zaburzenia widzenia
- II° – Obecność niewielkiej ilości krwi w stolcu, moczu, wymiotach, w plwocinie
- III° – Obecność większej ilości krwi w stolcu, moczu, wymiotach, w plwocinie – wymagająca przetoczenia KKP
- IV° – Zwiększona utrata krwi powodująca wystąpienie objawów ogólnych, pogorszenie stanu chorego, wylewy krwi do mózgu, krwotoki do siatkówki z zaburzeniem widzenia
Powikłania chemioterapii - utrata włosów w trakcie chemioterapii
Utrata włosów w trakcie chemioterapii jest częstą sytuacją w trakcie stosowania leków przeciwnowotworowych. Toksyczne uszkodzenie komórek mieszków włosowych dokonuje się po ok 2-4 tygodniach od początku chemioterapii i ma charakter przejściowy. Zazwyczaj około 5 tygodni po zakończeniu chemioterapii dochodzi do regeneracji komórek wytwarzających włosy, ale czasami regeneracja wymaga nawet 3-6 miesięcy.
Chemioterapia nie zawsze prowadzi do utraty włosów. Jest to związane z rodzajem chemioterapii (jakie leki są podawane) oraz od ich dawek. Do leków, które często powodują utratę włosów należy m.in. doksorubicyna, etopozyd, cyklofosfamin, busulfan.
Utrata włosów dotyczy nie tylko skóry owłosionej głowy. Działanie leków przeciwnowotworowych jest systemowe, dotyczy całego organizmu. Dlatego dochodzi także do utraty brwi, rzęs, owłosienia pachowego, łonowego.
Co można zrobić, żeby zminimalizować problem utraty włosów w trakcie chemioterapii?
- zapytać onkologa, czy planowana chemioterapia może spowodować wypadanie włosów
- rozmawiać o ewentualnych powikłaniach (z lekarzem, z rodziną) i zaplanować odpowiednie postępowanie
- zaprzestać wykonywania zabiegów na włosach (farbowanie, ondulacja itp.)
- zaleca się skrócić włosy przed chemioterapią (mniejsze przykre doznania gdy włosy zaczną wypadać, lepszy wygląd gdy włosy zaczną wypadać)
- zakup peruki zanim wystąpi problem po wypadnięciu włosów
- higiena skóry głowy (szampony antyalergiczne, ostrożne czesanie, delikatne wycieranie skóry głowy
- chronić głowę przed wyziębianiem i przegrzewaniem (słońce!)
Czy można coś zrobić, żeby uniknąć wypadania włosów w trakcie chemioterapii? Chemioterapia uszkadza komórki dzielące się, nie tylko nowotworowe, ale także szpiku, śluzówki przewodu pokarmowego czy mieszków włosowych. W tym ostatnim przypadku oziębienie skóry głowy (ale nie całej głowy !) pozwala na zmniejszenie metabolizmu komórki i mniejsze jej narażenie na działanie toksyczne leków przeciwnowotworowych. W tym celu opracowano specjalistyczne urządzenia chłodzące skórę głowy, które są dostępne w niektórych ośrodkach prowadzących chemioterapię.
Chemioterapia - wskazania do hospitalizacji
Leczenie nowotworów chemioterapią odbywa się zasadniczo w przychodniach onkologicznych. Pacjent nie musi przebywać w szpitalu, na chemioterapię podawaną dożylnie dojeżdża w czasie , w którym chemioterapia jest rozpisana. Pozwala to na prowadzenie życia rodzinnego, nie wymusza rezygnacji z codziennych, naturalnych zachowań czy upodobań. Zdecydowanie pozytywnie wpływa na stan psychiczny pacjenta.
Istnieją jednak sytuacje, w których może zachodzić konieczność pobytu w szpitalu (hospitalizacji). Do sytuacji takich należą m.in.:
- konieczność podawania wysokich dawek leków mogących uszkodzić nerki i w związku z tym wymagających długotrwałego i monitorowanego nawodnienia (np. cisplatyna w dawkach większych niż 75 mg)
- podawanie leków przeciwnowotworowych inną drogą niż dożylna (np. dotętnicza) lub wymagająca specjalistycznej procedury (np. chemioterapia podawana do tętnicy wątrobowej w połączeniu z jej zamknięciem – t.zw. chemoembolizacja)
- leczenie wymagające podawania wielu różnych leków przeciwnowotworowych, powodujących uszkodzenie komórek krwi i wymagających transfuzji krwi – np. leczenie indukcyjne ostrej białaczki
- podawanie wysokich dawek cytostatyków (leków przeciwnowotworowych) w celu zniszczenia komórek krwiotwórczych i następowej transplantacji szpiku
- konieczność podawania wysokich dawek cytostatyków co wymaga ścisłego monitorowania i kontroli stanu pacjenta
- podawanie leków powodujących znacznego stopnia wymioty, które mogą doprowadzić do zaburzeń wodno-elektrolitowych i w związku z tym wymagających odpowiedniego, specjalistycznego prowadzenia chorego (leki przeciwwymiotne, uzupełnianie płynów i elektrolitów), także w sytuacjach, gdy w trakcie chemioterapii prowadzonej ambulatoryjnie (poza szpitalem) występują trudne do opanowania wymioty
- zastosowanie niektórych schematów leczenia skojarzonego (radioterapia + chemioterapia)
- współistnienie innych chorób, które mogą negatywnie wpływać na stan zdrowia w trakcie prowadzonej chemioterapii (choroby serca, choroby płuc, cukrzyca, zaburzenia metaboliczne)
- programy leczenia systemowego wymagające długotrwałego podawania leków lub wymagające przedłużonego monitorowania stanu chorego
- sytuacje kliniczne, gdy chemioterapia rozpoczyna się w szpitalu (np. bezpośrednio po zabiegu operacyjnym) a następnie jest kontynuowana ambulatoryjnie
- chemioterapia podawana do jamy otrzewnej (np. Dootrzewnowa Chemioterapia Perfuzyjna w Hipertermii – HIPEC) lub podawana do jamy opłucnowej (np. przy przerzutach do opłucnej)
- konieczność prowadzenia chemioterapii ambulatoryjnej u chorego, dla którego jedyną możliwością zachowania ciągłości leczenia jest hospitalizacja (np. dla chorych dojeżdżających z odległych miejsc zamieszkania). W tych sytuacjach często proponowane jest zakwaterowanie w hotelach przyszpitalnych lub hotelach, które mają podpisana umowę ze szpitalem na tego typu usługi.
Opracowanie: Onkonet.pl
Artykuły uzupełniające zagadnienie chemioterapii
Piśmiennictwo:
- Onkologia kliniczna T1. Krzakowski M. i wsp. (Red). ViaMedica, Gdańsk, 2014;
- Stany nagłe w onkologii T2. Szawłowski A, Wallner G. (Red). TerMedia, Poznań 2015;
- Harrison’s Manual of Oncology. 2nd Edit. McGraw-Hill Education. 2014