
dla pacjentów i lekarzy
Czerniak złośliwy skóry - klasyfikacja i leczenie - opracowanie dla lekarzy
Spis treści:
1 Wstęp i epidemiologia czerniaka
2 Objawy czerniaka
3 Czynniki ryzyka
4 Badania diagnostyczne w przypadku czerniaka
5 Klasyfikacja czerniaka
5.1 Patomorfologiczna
5.2 Kliniczna
5.3 TNM
5.4 Stopień zaawansowania (ang. staging) czerniaka
6 Leczenie czerniaka
6.1 Chirurgiczne
6.2 Leczenie systemowe w przypadku przerzutów
6.3 Leczenie celowane – ukierunkowane molekularnie
6.4 Radioterapia
6.5 Chemioterapia
6.6 Szczepionki
6.7 Izolowana kończynowa chemioterapia perfuzyjna
7 Rokowania w przypadku czerniaka
8 Zalecenia Konsultanta Krajowego w dziedzinie chirurgii onkologicznej oraz PTChO w zakresie diagnostyki i leczenia chorych na czerniaki
9 Więcej materiałów na temat czerniaka
Klasyfikacja czerniaka złośliwego skóry
Klasyfikacja patomorfologiczna
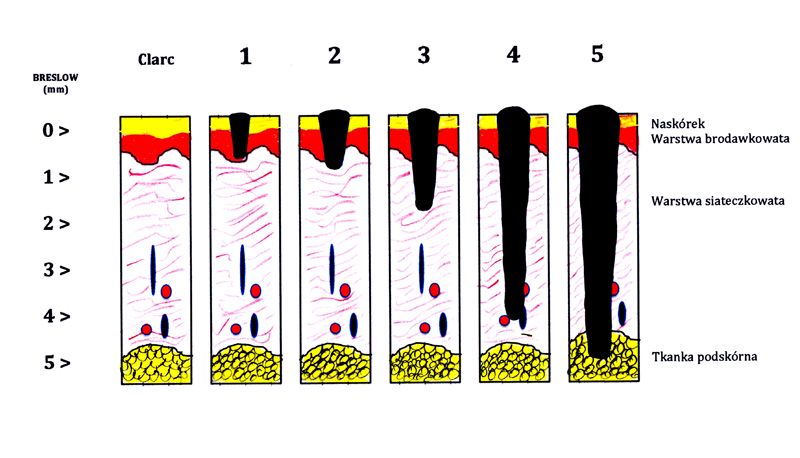
Stosowane są dwie klasyfikacje, z których jedna ocenia głębokość naciekania poszczególnych warstw skóry (klasyfikacja Clarka), zaś druga ocenia głębokość naciekania skóry w milimetrach (klasyfikacja według Breslow) - zalecana jako podstawowa klasyfikacja oceny zaawansowania miejscowego czerniaka.
Klasyfikacja Clarka:
I° – czerniak ograniczony do naskórka
II° – czerniak nacieka warstwę brodawkowata skóry
III° – czerniak dochodzi do warstwy siateczkowatej skóry, ale bez jej naciekania
IV° – czerniak nacieka warstwę siateczkowatą
V° – czerniak nacieka tkankę podskórną
W ocenie rokowania ważniejsza jest klasyfikacja Breslow, która jest bardziej wiarygodna aniżeli klasyfikacja Clarka. Ta ostatnia jest pomocna przy ocenie czerniaka do 1 mm grubości (różnicowanie pomiędzy II° i III° według Clarka).
Rys. 1. Klasyfikacja patomorfologiczna czerniaka wg Breslow:
Klasyfikacja kliniczna czerniaka
Wyróżnia się następujące postacie kliniczne czerniaka:
- postać powierzchowna (typ powierzchowny – SSM – superficial spreading melanoma)
- postać guzowata (typ guzowaty – NM – nodular melanoma)
- czerniak w plamie soczewicowatej (LMM – lentigo malignant melanoma)
- czerniak dosiebnych części ciała:
- czerniak powierzchni dłoniowej lub podeszwowej (acral lentiginous melanoma)
- czerniak podpaznokciowy (melanoma subunguale)
Najczęstsza postacią jest typ powierzchowny SSM, stanowiący około 70% wszystkich czerniaków. Typ guzowaty NM stanowi 10% do 20%, czerniak w plamie soczewicowatej około 5% i czerniak dosiebnych części kończyn 5% przypadków.
Klasyfikacja TNM czerniaka (8. edycja UICC)
Podstawowym systemem klasyfikacji klinicznej czerniaka jest skala TNM. Ocenie poddaje się stopień zaawansowania miejscowego, ocenianego zarówno według klasyfikacji Breslow, a także obecność owrzodzenia w obrębie czerniaka, ilość figure podziału w mm2 (Indeks Mitotyczny - IM) i występowanie ognisk satelitarnych (ogniska czerniaka występujące w odległości do 2 cm od brzegu ogniska pierwotnego). Ogniska występujące w większej odległości niż 2 cm określamy jako przerzuty in-transit. Następnym ocenianym elementem są przerzuty do regionalnych węzłów chłonnych (cecha N - nodule) oraz obecność przerzutów odległych (cecha M – metastases).
| T (tumor) - guz pierwotny nowotworu | |
|---|---|
| Tx | nie można ocenić guza pierwotnego |
| T0 | nie stwierdza się obecności guza pierwotnego |
| Tis | czerniak in-situ (Clark I°) (atypowa hyperplasia melanocytarna, dysplazja znacznego stopnia, czerniak bez cech naciekania) |
| T1 | guz o grubości 1,0 mm lub mniejszej |
| T1a | guz o grubości do 0,8 mm bez owrzodzenia |
| T1b | guz o grubości do 0,8 mm z owrzodzeniem lub guz o grubości > 0,8 mm i ≤ 1,0 mm z owrzodzeniem lub bez owrzodzenia |
| T2 | guz o grubości > 1,0 mm do 2,0 mm |
| T2a | guz o grubości > 1,0 mm do 2,0 mm, bez owrzodzenia |
| T2b | guz o grubości > 1,0 mm do 2,0 mm, z owrzodzeniem |
| T3 | guz o grubości > 2,0 mm do 4,0 mm |
| T3a | guz o grubości > 2,0 mm do 4,0 mm, bez owrzodzenia |
| T3b | guz o grubości > 2,0 mm do 4,0 mm, z owrzodzeniem |
| T4 | guz o grubości > 4 mm |
| T4a | guz o grubości > 4,0 mm, bez owrzodzenia |
| T4b | guz o grubości > 4,0 mm, z owrzodzeniem |
| N (lymph nodes) - stan regionalnych węzłów chłonnych | |
|---|---|
| Nx | brak możliwości oceny węzłów chłonnych |
| N0 | brak przerzutów do regionalnych węzłów chłonnych |
| N1 | przerzuty w 1 regionalnym węźle chłonnym lub przerzuty (in-transit lub satelitarne) bez przerzutów do regionalnych węzłów chłonnych |
| N1a | mikroprzerzuty do 1 węzła chłonnego |
| N1b | makroprzerzuty do 1 węzła chłonnego |
| N1c | przerzuty (satelitarne lub in-transit) bez przerzutów do węzłów chłonnych |
| N2 | przerzuty w 2 – 3 regionalnych węzłach chłonnych lub przerzuty (in-transit lub satelitarne) z obecnością przerzutów w 1 regionalnym węźle chłonnym |
| N2a | mikroprzerzuty do 2 lub 3 węzłów chłonnych |
| N2b | makroprzerzuty do 2 lub 3 węzłów chłonnych |
| N2c | przerzuty (satelitarne lub in-transit) z obecnością przerzutów w 1 węźle chłonnym |
| N3 | przerzuty do 4 i więcej regionalnych węzłów chłonnych lub konglomerat węzłów chłonnych lub (przerzuty satelitarne lub przerzuty in-transit) z obecnością przerzutów w 2 lub więcej regionalnych węzłach chłonnych |
| N3a | mikroprzerzuty do węzłów chłonnych (4 lub więcej) |
| N3b | makroprzerzuty do węzłów chłonnych (4 lub więcej) |
| N3c | przerzuty (satelitarne lub in-transit) z obecnością przerzutów w 2 lub więcej węzłach chłonnych |
| M (metastases) - przerzuty odległe | |
|---|---|
| M0 | nie stwierdza się obecności przerzutów odległych |
| M1 | obecne przerzuty odległe |
| M1a | przerzuty do skóry, tkanki podskórnej lub węzłów chłonnych poza regionalnym dla guza pierwotnego obszarem spływu chłonki |
| M1b | przerzuty do płuc |
| M1c | przerzuty do innych narządów z wyłączeniem przerzutów do OUN |
| M1d | przerzuty do OUN (ośrodkowy układ nerwowy) |
dodatkowe oznaczenie dla cechy M: (0) - poziom LDH niepodwyższony (1) - poziom LDH podwyższony
Stopień zaawansowania (ang. staging) na podstawie TNM (aktualizacja 01/2018)
| Stopień zaawansowania czerniaka - ocena kliniczna (cTNM) | |
|---|---|
| Stopień 0 | Tis N0 M0 |
| Stopień IA | T1a N0 M0 |
| Stopień IB | T1b N0 M0 |
| T2a N0 M0 | |
| Stopień IIA | T2b N0 M0 |
| T3a N0 M0 | |
| Stopień IIB | T3b N0 M0 |
| T4a N0 M0 | |
| Stopień IIC | T4b N0 M0 |
| Stopień III | T(każdy) N≥1 M0 |
| Stopień IV | T(każdy) N(każdy) M1 |
| Stopień zaawansowania czerniaka - ocena patologiczna (pTNM) | |
|---|---|
| Stopień 0 | Tis N0 M0 |
| Stopień IA | T1a N0 M0 |
| T1b N0 M0 | |
| Stopień IB | T2a N0 M0 |
| Stopień IIA | T2b N0 M0 |
| T3a N0 M0 | |
| Stopień IIB | T3b N0 M0 |
| T4a N0 M0 | |
| Stopień IIC | T4b N0 M0 |
| Stopień IIIA | T1a/b,T2a N1a,N2a M0 |
| Stopień IIIB | T0 N1b,N1c M0 |
| T1a/b,T2a N1b/c,N2b M0 | |
| T2b,T3a N1a/b/c,N2a/b M0 | |
| Stopień IIIC | T0 N2b/c,N3b/c M0 |
| T1a/b,T2a/b,T3a N2c,N3a/b/c M0 | |
| T3b,T4a Każde N ≥N1 M0 | |
| T4b N1a/b/c,N2a/b/c M0 | |
| Stopień IIID | T4b N3a/b/c M0 |
| Stopień IV | T(każdy) N(każdy) M1 |
Leczenie czerniaka
Leczenie chirurgiczne
Leczenie czerniaka polega na radykalnym wycięciu nowotworu, wraz z marginesem skóry zdrowej o szerokości 1 cm dla czerniaka o grubości do 2 mm. W przypadku, gdy grubość naciekania jest większa aniżeli 2 mm, margines wycięcia skóry zdrowej wynosi od 2 do 3 cm. W takim przypadku należy także wyciąć powięź powierzchowną, podczas gdy w czerniaku o grubości poniżej 2 mm nie jest to zalecane.
W przypadku powiększonych, wyczuwalnych klinicznie regionalnych węzłów chłonnych należy wykonać ich wycięcie (limfadenektomia selektywna). W przypadku braku klinicznie wyczuwalnych węzłów chłonnych, gdy czerniak jest grubszy aniżeli 1 mm, należy wykonać ocenę regionalnych węzłów chłonnych za pomocą metody identyfikacji i badania węzła wartowniczego.
Węzeł wartowniczy jest to pierwszy węzeł na drodze naczyń chłonnych biegnących od strony guza w stronę regionalnego układu chłonnego. Jeśli istnieją przerzuty do regionalnych węzłów chłonnych to w 99% przypadków będą się one znajdowały w węźle wartowniczym.
Biopsja węzła wartowniczego polega na podaniu śródskórnie, w czterech miejscach wokół czerniaka, w odległości 0,5 – 1,0 cm od jego brzegu izotopu technetu rozpuszczonego w odpowiednim nośniku. Metoda izotopowa może być łączona z metodą barwnikową. Znacznik przechodzi do naczyń limfatycznych i wędruje do węzła wartowniczego. Zmiana zabarwienia węzła na zielono-niebieski lub obecność promieniowania z węzła wykrywanego ręcznym detektorem promieniowania gamma (gamma-probe, gamma-kamera) pozwala na identyfikację węzła wartowniczego i jego wycięcie. W celu przedoperacyjnej identyfikacji wizualnej umiejscowienia węzła wartowniczego można wykonać stacjonarne badanie izotopowe układu chłonnego (limfoscyntygrafia). W przypadku uwidocznienia węzła wartowniczego w tym badaniu jego znalezienie w trakcie zabiegu operacyjnego z użyciem gamma-kamery jest równe 100%.
Profilaktyczne wycięcie regionalnych węzłów chłonnych (limfadenektomia elektywna) nie ma racjonalnego wykorzystania w diagnostyce i leczeniu czerniaka, co udowodniły badania EORTC.
Po wycięciu guza pierwotnego ubytek tkanek może być zamknięty poprzez pierwotne zeszycie rany. Jeśli obszar wycięcia jest duży lub warunki anatomiczne uniemożliwiają pierwotne zeszycie rany, należy ranę pokryć przeszczepem skóry niepełnej grubości, pobranym z uda. Opatrunek uciskowy należy zostawić na 3 dni, zaś po tym okresie zdjąć opatrunek i ocenić postęp w przyjmowaniu się przeszczepu.
Leczenie systemowe w przypadku przerzutów odległych lub czerniaka nieoperacyjnego
Leczenie immunologiczne – I rzut leczenia:
Nivolumab: 3 mg/kg, i.v., co 2 tyg.
Nivolumab + Ipilimumab: Nivolumab 1 mg/kg i Ipilimumab 3 mg/kg, i.v., co 3 tyg., 4 cykle. Następnie Nivolumab 3 mg/kg co 2 tyg.
Pembrolizumab: 2 mg.kg., i.v., co 3 tyg.
Leczenie immunologiczne – I rzut leczenia u chorych z mutacją BRAF:
Dabrafenib + Trametinib: Dabrafenib 150 mg doustnie 2x/dziennie i Trametinib 2 mg/kg doustnie, codziennie
Vemurafenib + Cobimetinib: Vemurafenib 960 mg, doustnie, 2x dziennie w dniach 1-28 i Cobimetinib 60 mg dziennie, doustnie w dn. 1-21. Cykle powtarza się co 28 dni
Leczenie immunologiczne – II rzut leczenia:
Pembrolizumab: 2 mg.kg., i.v., co 3 tyg.
Nivolumab: 3 mg/kg, i.v., co 2 tyg.
Nivolumab + Ipilimumab: Nivolumab 1 mg/kg i Ipilimumab 3 mg/kg, i.v., co 3 tyg., 4 cykle. Następnie Nivolumab 3 mg/kg co 2 tyg.
Ipilimumab: Ipilimumab 3 mg/kg i.v. Leczenie powtarza się co 3 tyg.
Interleukina 2 (IL-2): IL-2 22 mcg/kg (360.000 IU/kg) we wzrastających dawkach do progu tolerancji dawki
Imatinib: Imatinib 400 mg doustnie, 2x/dziennie
Leczenie immunologiczne – II rzut leczenia u chorych z mutacją BRAF:
Dabrafenib + Trametinib: Dabrafenib 150 mg doustnie 2x/dziennie o Trametinib 2 mg/dziennie, doustnie
Vemurafenib + Cobimetinib: Vemurafenib 960 mg, doustnie, 2x dziennie w dniach 1-28 i Cobimetinib 60 mg dziennie, doustnie w dn. 1-21. Cykle powtarza się co 28 dni
Vemurafenib: Vemurafenib 960 mg, doustnie, 2x dziennie
Dabrafenib: Dabrafenib 150 mg doustnie 2x dziennie
Leczenie miejscowe czerniaka w III stopniu zaawansowania w przypadku zmian nieresekcyjnych, wyciętych częściowo lub nieoperacyjnej wznowy po wycięciu - w formie iniekcji doguzowych
Alimogen laherarepvec (TVEC) – szczepionka oparta o zmodyfikowane genetycznie wirusy herpes simplex. Więcej informacji o TVEC w artykule: Wirusy przeciwko nowotworom - nowe możliwości w leczeniu czerniaka
Szczepionka Bacillus Calmette-Guerin (BCG)
Interferon alfa-2b
Interleukina 2 (IL-2)
Leczenie przerzutów in-transit na kończynach:
Izolowana kończynowa chemioterapia perfuzyjna i infuzyjna (ILP – isolated limb perfusion, ILI – isolated limb infusion))
Leczenie celowane czerniaka
Leczenie celowane czerniaka - wprowadzenie
U około 50% chorych na czerniaka występuje mutacja genu BRAF, odpowiadającego za produkcję jednego z białek przekaźnikowych (kinaz) działających w szlaku sygnałowym MAPK, który odpowiada za kontrolę nad wzrostem i proliferacją (mnożeniem się) komórek. Zaburzenie tego szlaku, w wyniku mutacji BRAF, prowadzi do niekontrolowanej proliferacji komórek i rozwoju nowotworu.
Leki celowane działają w oparciu o zablokowanie kinazy BRAF, co skutkuje przerwaniem szlaku MAPK i spowolnieniem namnażania się komórek nowotworowych. Do tej grupy leków należą dabrafenib oraz wemurafenib. Dwa inne leki trametinib i cobimetinib blokują inną kinazę - MEK, położoną dalej w tym samym szlaku sygnałowym MAPK, również prowadząc do przerwania szlaku i spowolnienia namnażania się komórek nowotworowych.
Leczenie celowane czerniaka - mechanizm działania
Każda komórka organizmu musi posiadać zdolność odbierania sygnałów dochodzących ze środowiska zewnętrznego oraz reagowania na nie. Sygnały dochodzące do komórki uaktywniają szereg procesów związanych z jej funkcjonowaniem, w tym te odpowiedzialne za podziały komórkowe. Poznanie mechanizmów związanych z przesyłaniem informacji do komórki doprowadziło do wynalezienia leków blokujących sygnały aktywujące zdolność komórek nowotworowych do dzielenia się i namnażania.
Prawidłowo przebiegający proces proliferacji (dzielenia się i namnażania) komórek jest zależny od oddziaływania czynników aktywujących podziały komórkowe. Czynniki takie nazywa się mitogenami. Sygnały pochodzące od mitogenów są przekazywane w komórce za pomocą enzymów przekaźnikowych zwanych kinazami. Kinazy uczestniczące w procesie regulacji podziałów komórkowych nazywa się mianem kinaz aktywowanych mitogenami (MAPK – ang. mitogen-activated protein kinases). Do kinaz MAP należą kinazy, takie jak białko RAS (kinaza RAS - KRAS), kinaza RAF (białko B-Raf, BRAF), kinazy MEK oraz ERK (kinazy efektorowe).
Kaskada enzymów MAPK jest odpowiedzialna za regulację takich procesów komórkowych jak proliferacja, apoptoza oraz różnicowanie się komórek. Wzorce budowy białek tych enzymów są zakodowane w komórce, w odpowiednich genach. W przypadku mutacji tych genów dochodzi do produkcji białek w zmienionej, nieprawidłowej formie, która zaburza ich normalne funkcjonowanie.
W swojej prawidłowej postaci kinazy MAPK, reagują jedynie na sygnał pochodzący z zewnątrz komórki, od organizmu. Dzięki temu proces podziałów komórkowych przebiega normalnie. Natomiast w przypadku mutacji nieprawidłowo zmienione białka zaczynają przekazywać sygnał do podziału komórek w sposób niekontrolowany, a organizm nie jest wstanie powstrzymać tego procesu. Skutkiem jest wzrost nowotworu i jego rozprzestrzenianie się w organizmie (przerzuty).
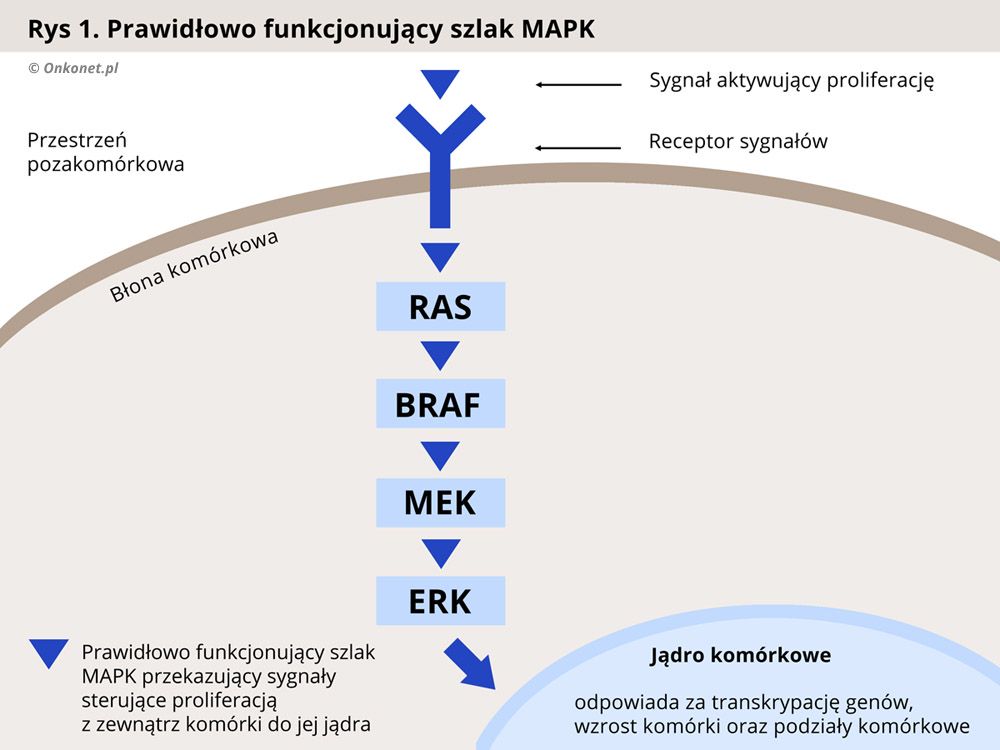
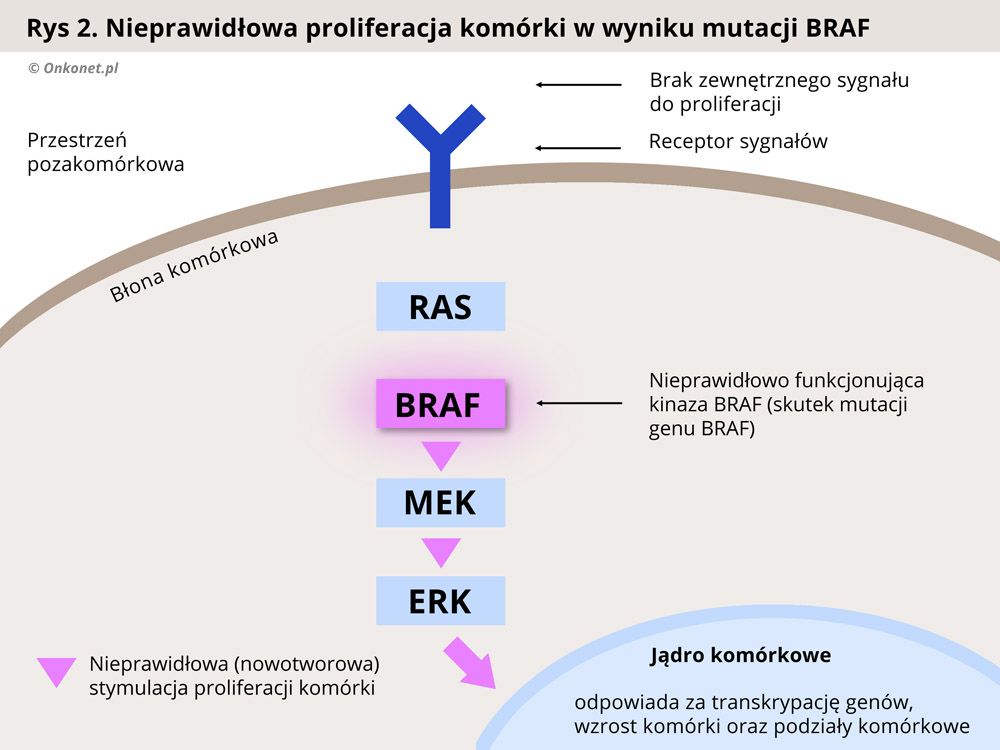
Badania genetyczne nad mutacjami w genach kodujących białka szlaku przekazywania sygnałów zewnętrznych do komórki doprowadziły do wynalezienia substancji blokujących poszczególne kinazy (enzymy przekaźnikowe). Zablokowanie nieprawidłowo działającej kinazy przerywa szlak sygnałów prowadzących do wzrostu i podziałów komórki nowotworowej, prowadząc w efekcie do spowolnienia rozwoju nowotworu.
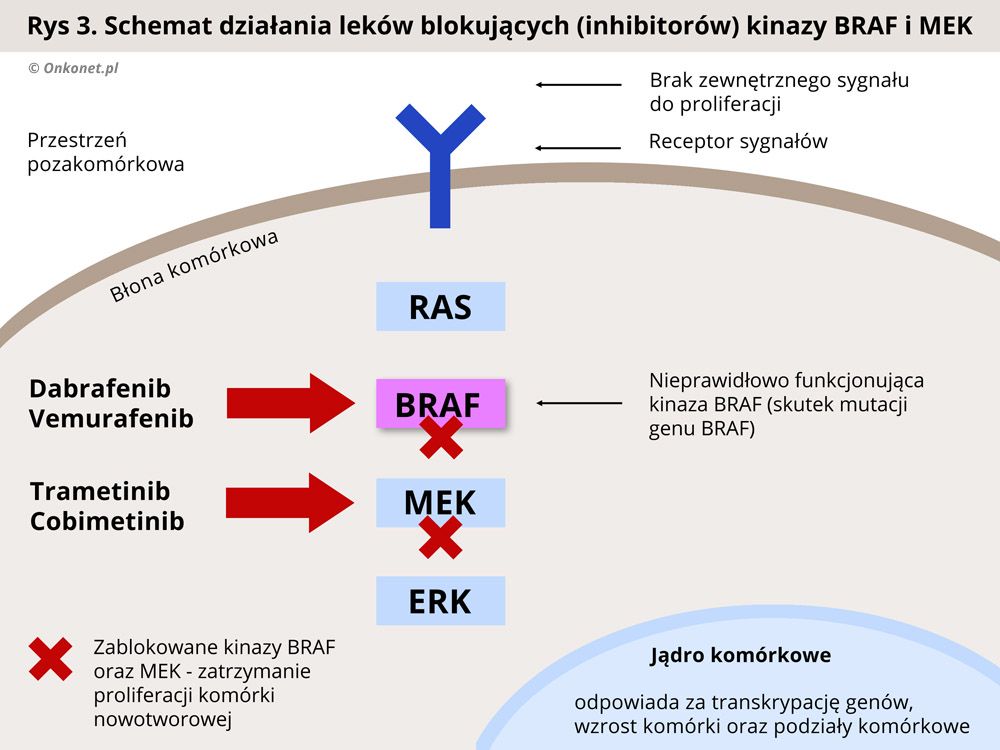
Jedną z najczęstszych mutacji obserwowanych w czerniaku, występującą u około 50% chorych, jest mutacja genu BRAF, z czego w 90% przypadków stwierdza się mutację BRAF V600. Lekami hamującymi kinazę BRAF są dabrafenib i vemurafenib.
Z kolei trametinib i cobimetinib hamują kinazy MEK i blokują w ten sposób dalsze przekazywanie sygnału do kinaz efektorowych ERK. Często, dla wzmocnienia działania, stosuje się jednocześnie leki blokujące kinazy BRAF i MEK.
Dzięki postępowi w badaniach genetycznych medycyna otrzymała leki pomagające leczyć czerniaka nawet w zaawansowanym stadium, prowadzące do istotnego wydłużenia życia chorych.
Radioterapia
Radioterapia jest stosowana w czerniaku w następujących przypadkach:
- dyskwalifikacja chorego od zabiegu operacyjnego
- brak zgody chorego na zabieg operacyjny
- jako leczenie miejscowe w przypadkach braku możliwości wykonania zabiegu radykalnego
- jako leczenie uzupełniające zabieg operacyjny, który nie był doszczętny
- paliatywnie w przypadku przerzutów do kości
- w przypadku czerniaka gałki ocznej, jako leczenie uzupełniające
Chemioterapia
Chemioterapia nie jest stosowana rutynowo jako leczenie uzupełniające zabieg operacyjny. Ze względu na niski stopień odpowiedzi na leczenie (około 15% - 20%), chemioterapię w czerniaku stosuje się jako leczenie paliatywne, mające na celu złagodzenie objawów spowodowanych przez ten nowotwór. Do wskazań do chemioterapii, poza leczeniem w ramach kontrolowanych badań klinicznych, należą:
- nieoperacyjne zmiany w obrębie skóry lub powierzchownych węzłów chłonnych o ograniczonej wielkości guza
- pojedyncze, rozsiane zmiany w płucach
- przewidywany korzystny wpływ na jakość życia chorego
Szczepionki
Prowadzone są liczne badania nad zastosowaniem szczepionek produkowanych zarówno z materiału własnego pacjenta oraz linii komórkowych, a także preparatów działających nieswoiście. Badania prowadzone są w ramach kontrolowanych prób klinicznych zarówno przez firmy farmaceutyczne jak i organizacje badające zastosowania nowych leków (np. EORTC – European Organization for Research and Treatment of Cancer).
Izolowana kończynowa chemioterapia perfuzyjna
W przypadku istnienia przerzutów do skóry lub tkanki podskórnej w odległości większej aniżeli 2 cm od brzegu guza pierwotnego (tj. w przypadku wystąpienia przerzutów in-transit) leczenie polega na wykonaniu izolowanej kończynowej chemioterapii perfuzyjnej. Postępowanie to polega na zastosowaniu dużych dawek leków przeciwnowotworowych (cytostatyki) w izolowanej od krążenia systemowego kończynie. Do najczęstszych cytostatyków używanych w perfuzji należy TNF (tumor necrosis factor), Melphalan, Mitoxantron, Cisplatyna i, rzadko, DTIC (dakarbazyna). Kończyna jest ogrzewana do 41-42°C, hipertermia działa synergistycznie z cytostatykami w celu zniszczenia komórek nowotworowych. Nie ma wskazań do leczenia uzupełniającego zabieg operacyjny za pomocą perfuzji kończynowej - badanie EORTC wykazało brak skuteczności takiego postępowania, przy jednoczesnym narażeniu chorych na poważne powikłania związane z tym typem zabiegu.
Rokowania w czerniaku złośliwym skóry
Rokowanie w czerniaku jest zależne od głębokości naciekania oraz stopnia zaawansowania klinicznego. We wczesnych stopniach zaawansowania (grubość naciekania do 1 mm) wyleczalność sięga 90-100 %.
Opracowanie:
dr hab. n. med. Tomasz Jastrzębski, prof. ndzw. GUMed
Klinika Chirurgii Onkologicznej
Uniwersyteckie Centrum Kliniczne w Gdańsku,
Zalecenia Konsultanta Krajowego w dziedzinie chirurgii onkologicznej oraz Polskiego Towarzystwa Chirurgii Onkologicznej w zakresie diagnostyki i leczenia chorych na czerniaki
Rekomendacje ogólne:
Zaleca się aby chorzy na czerniaka byli leczeni wyłącznie w specjalistycznych ośrodkach referencyjnych lub w jednostkach z dużym doświadczeniem w których jest Leczonych minimum 50 chorych na czerniaka rocznie. Leczenie chorych na czerniaka powinien prowadzić specjalista chirurgii onkologicznej. Leczenie chorych na czerniaka ma charakter wielodyscyplinarny.
Ośrodki medyczne wykonujące procedury diagnostyczno-terapeutyczne powinny mieć następujące możliwości:
Organizacyjne:
Pracownię histopatologiczną w miejscu;
Zakład medycyny nuklearnej w miejscu;
Zakład radioterapii w miejscu lub umowa z ośrodkiem zewnętrznym;
Możliwość wykonania dermatoskopii i badania USG w miejscu;
Możliwość wykonania procedury biopsji węzła wartowniczego w miejscu oraz jego oceny histopatologicznej;
Możliwość wykonania scyntygrafii, TK, PET-TK w miejscu lub na podstawie umowy z ośrodkiem zewnętrznym,
Możliwość wykonania oznaczenia mutacji BRAF w miejscu lub na podstawie umowy z ośrodkiem zewnętrznym.
Merytoryczne - w zakresie diagnostyki:
W przypadku podejrzenia czerniaka skóry u każdego chorego powinno się:
1. Wykonać biopsję wycinającą zmiany podejrzanej, przeprowadzoną zgodnie z rekomendacjami;
2. U każdego chorego z potwierdzonym histopatologicznie czerniakiem należy wykonać USG regionalnych węzłów chłonnych z ewentualną weryfikacją BAC węzłów podejrzanych o przerzuty.
3. W stopniu zaawansowania TNM IIIB/C i wyższym przed każdorazowym leczeniem chirurgicznym należy oznaczyć LDH oraz rozważyć wykonanie badania PET
Merytoryczne - w zakresie leczenia:
A. W przypadku histologicznego rozpoznania czerniaka po biopsji wycinającej należy poszerzyć zabieg pierwotny poprzez wycięcie blizny z marginesem niezmienionej skóry; szerokość poszerzenia wycięcia zależy od lokalizacji zmiany oraz głębokości naciekania wg Breslowa.
B. W przypadku:
- potwierdzenia przerzutów w regionalnych węzłach chłonnych należy wykonać limfadenektomię;
- braku takiego podejrzenia i gdy grubość nacieku wg Breslowa wynosi powyżej 1 mm należy wykonać biopsję węzła wartowniczego, a decyzję o uzupełniającej limfadenektomii uzależnić od ewentualnej obecności przerzutu w węźle wartowniczym; biopsję węzła wartowniczego należy także wykonać w przypadku
czerniaków >0,8 mm jeśli współwystępują inne czynniki ryzyka (m.in. owrzodzenie, liczba mitoz >1/mm 2).
C. U chorego po terapeutycznej limfadenektomii charakteryzującego się dużym ryzykiem nawrotu regionalnego należy rozważyć leczenie uzupełniające.
D. W przypadku izolowanych przerzutów odległych (np. w tkance podskórnej, węzłach chłonnych, tkankach miękkich, narządach jamy brzusznej, płucu, mózgu) należy rozważyć leczenie operacyjne (z założeniem całkowitego usunięcia zmian przerzutowych).
E. W przypadku nieresekcyjnych przerzutów należy rozważyć zastosowanie leczenia systemowego lub kwalifikację chorego do badań klinicznych.
F. W przypadku potwierdzenia przerzutów odległych czerniaka należy wykonać oznaczenie mutacji BRAF.