
dla pacjentów i lekarzy
Nowy, skuteczny lek w terapii guzów neuroendokrynnych przewodu pokarmowego
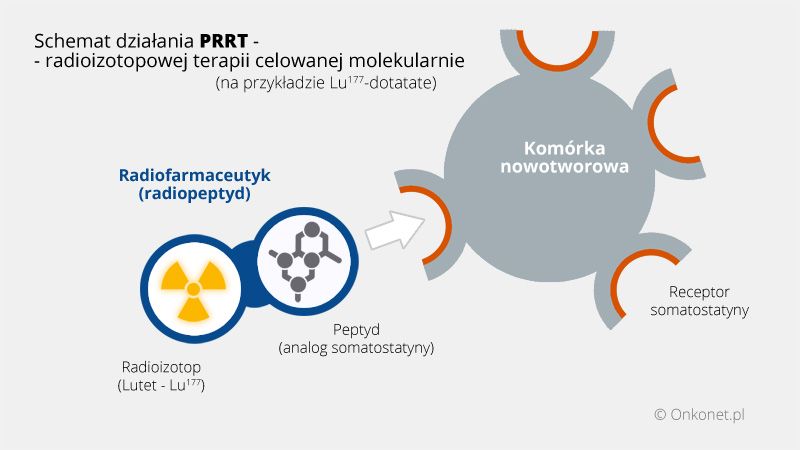
Amerykańska Agencja Żywności i Leków (FDA) zarejestrowała nowy lek stosowany w terapii guzów neuroendokrynnych przewodu pokarmowego. Lutathera (Lu177-dotatate) należy do innowacyjnej kategorii leków/terapii nazywanych PRRT. W Lutatherze wykorzystano izotop Lutetu (Lu177) jako substancję radioizotopową.
Radioizotopowa terapia celowana molekularnie (ang. PRRT - peptide receptor radionuclide therapy) jest formą terapii radioizotopowej, w której specjalnie dobrany peptyd, posiadający właściwość przyłączania się do komórki nowotworowej, jest połączony z niewielką ilością materiału radioaktywnego tworząc razem lek (radiofarmaceutyk) nazywany radiopeptydem. Po wstrzyknięciu do krwioobiegu pacjenta radiopeptyd przemieszczając się wraz z krwią dociera do nowotworu i przyłącza się do komórek nowotworowych, dostarczając wprost do komórek nowotworu terapeutyczną dawkę promieniowania radioizotopowego.
W przypadku Lu177-dotatate peptyd został tak dobrany, by łączyć się z receptorami somatostatyny obecnymi w 80% guzów neuroendokrynnych.
Lek został zarejestrowany w poparciu o pozytywne wyniki badań klinicznych trzeciej fazy, które wykazały zdecydowaną skuteczność w leczeniu przerzutowych guzów neuroendokrynnych przewodu pokarmowego w porównaniu z grupą kontrolną leczoną oktreotydem.
Badanie wykazało wydłużenie okresu wolnego od rozwoju nowotworu (progresji) mierzonego okresem 20-miesięcznym aż u 65,2% chorych leczonych Lutetem Lu177 w porównaniu do jedynie 10,8% u chorych w grupie kontrolnej. Odsetek pozytywnej odpowiedzi na leczenie był 6-krotnie wyższy w grupie badanej przyjmującej nowy lek (18% w stosunku do 3%). Pacjenci leczeni Lu177 wykazywali także mniejsze ryzyko wzrostu guza i zgonów z powodu choroby.
Źródła:
- Strosberg J, El-Haddad G, Wolin E, et al. Phase 3 trial of 177Lu-Dotatate for midgut neuroendocrine tumors. N Engl J Med. 2017;376(2):125-35
- FDA approves new treatment for certain digestive tract cancers, FDA US Food and Drug Administration News Release; January 26, 2018.