
dla pacjentów i lekarzy
Rak piersi - opracowanie dla lekarzy
Spis treści:
1. Wstęp i epidemiologia
1.1 Rak piersi - pytania i odpowiedzi
2. Czynniki ryzyka
2.1 Genetyczne czynniki ryzyka
3. Objawy raka piersi
4. Diagnostyka
4.1 Mammografia
4.2 Ultrasonografia (USG)
4.3 Elastografia
4.4 Biopsja cienkoigłowa i gruboigłowa
4.5 Rezonans magnetyczny (MRI)
4.6 Schemat diagnostyki raka piersi
5. Klasyfikacja i ocena stopnia zaawansowania raka piersi
5.1 Klasyfikacja histologiczna
5.2 Klasyfikacja TNM raka piersi
5.3 Stopnień zaawansowania (ang. staging) raka piersi
6. Czynniki prognostyczne
7. Leczenie
7.1 Chirurgiczne - wprowadzenie
7.2 Chirurgiczne - leczenie oszczędzające pierś (BCT)
7.2.1 Biopsja węzła wartowniczego
7.3 Chirurgiczne - amputacja piersi sposobem Maddena, sposobem Patey'a
7.4 Chirurgiczne - możliwość rekonstrukcji piersi po wykonaniu amputacji
7.5 Chirurgiczne - amputacja prosta piersi
7.6 Leczenie neoadjuwantowe (indukcyjne) raka piers
7.7 Leczenie uzupełniające po zabiegu radykalnym
7.8 Schematy chemioterapii
8. Badania kontrolne
9. Inne materiały na temat raka piersi
Wstęp i epidemiologia
Rak piersi jest najczęściej występującym nowotworem złośliwym wśród kobiet w Polsce. Według danych Centrum Onkologii - Krajowego Rejestru Nowotworów - liczba zachorowań przekroczyła w 2017 roku ilość 18000 przypadków rocznie, wzrastając w ciągu dwóch ostatnich dekad o około 10 000.
W 2017 roku wykryto 18667 nowych przypadków raka piersi oraz stwierdzono 6741 zgonów z tego powodu. Pod względem ilości zgonów, rak piersi od kilku lat plasuje się w czołówce wśród nowotworów złośliwych. W 2017 roku jest drugim, po raku oskrzeli i płuca, nowotworem złośliwym powodującym najwięcej zgonów wśród kobiet w Polsce.
Największą zachorowalność notuje się u kobiet w przedziale wiekowym 55-65 lat, u młodszych jest ona znacznie mniejsza. Najwięcej zgonów zarejestrowano wśród kobiet w szóstej i siódmej dekadzie życia (51-69 lat). Rak piersi u mężczyzn występuje bardzo rzadko - w 2017 roku zachorowało 138 mężczyzn, najwięcej w siódmej dekadzie życia.
Jeśli chodzi o rozmieszczenie geograficzne, najwięcej zachorowań na raka piersi wśród kobiet statystyki podają dla województwa mazowieckiego i śląskiego, zgony z powodu raka piersi wśród kobiet również są w Polsce najczęstsze dla tych regionów. Najwięcej mężczyzn choruje na raka piersi w województwach wielkopolskim i mazowieckim.
Czynniki ryzyka raka piersi
Opisywanych jest wiele różnych czynników, mogących mieć wpływ na powstawanie raka piersi. Należą do nich czynniki genetyczne, hormonalne, środowiskowe, czynniki związane z dietą, prokreacją czy narażeniem na promieniowanie jonizujące. Do poznanych czynników ryzyka należy:
- płeć
- wiek - wzrost zachorowalności po 35 roku życia, najwięcej zachorowań pomiędzy 50 – 70 rokiem życia.
- czynniki genetyczne - występowanie raka piersi w rodzinie, szczególnie u krewnych pierwszego stopnia (matka, siostra). Ryzyko wzrasta, gdy nowotwory te występują zarówno u matki i siostry, przed 35 r.ż. Rak piersi uwarunkowany genetycznie stanowi do 10% wszystkich jego postaci. Może objawiać się występowaniem także innych nowotworów poza rakiem piersi: jajnika, trzonu macicy, prostaty, jelita grubego. Odpowiedzialnością za powstawanie genetycznie uwarunkowanego raka piersi obarcza się mutacje genów: BRCA1, BRCA2, p53, ATM. Opisano kilka uwarunkowanych dziedzicznie zespołów, gdzie występują nowotwory piersi: dziedziczny rak piersi – site specific, zespół rak piersi-rak jajnika, zespół Li-Fraumeni, zespół Lynch II, choroba Cowdena, zespół Peutz-Jaeghersa, ataxia-teleangiectasia, zespół Klinefeltera.
- czynniki hormonalne endogenne - większe ryzyko obserwuje się u kobiet, u których pierwsza miesiączka wystąpiła wcześnie lub późne klimakterium (powyżej 55 r.ż.), wiek pierwszej donoszonej ciąży (ryzyko wzrasta u kobiet które nie rodziły lub urodziły po raz pierwszy po 30 r.ż.)
- czynniki hormonalne egzogenne – hormonalne środki antykoncepcyjne. Nadal toczy się dyskusja o zagrożeniu rakiem piersi kobiet przyjmujących środki antykoncepcyjne hormonalne. Uważa się, że o ile preparaty zawierające jedynie progesteron nie wpływają na ryzyko wystąpienia raka piersi, o tyle środki zawierające zarówno progesteron jak i estrogeny mogą mieć wpływ na powstanie tego nowotworu. Bardziej prawdopodobne jest, że mogą być czynnikiem promującym istniejące wcześniej zmiany przedrakowe. Ryzyko zachorowania wzrasta u kobiet przyjmujących środki hormonalne dłużej niż 8 lat.
- czynniki hormonalne egzogenne - hormonoterapia zastępcza – stosowana coraz częściej w okresie przekwitania, zwiększa ryzyko zachorowania na raka piersi o około 6%, wzrastając do 30% przy hormonoterapii trwającej ponad 10 lat.
- choroby piersi z proliferacją: ryzyko wzrasta w przypadku stwierdzenia zmian rozrostowych, takich jak hyperplasia atypowa lub LCIS. Rozrost wewnątrzprzewodowy z atypią jest uważany za stan przedrakowy.
Należy pamiętać jednak o tym, że u 75% kobiet nie występują żadne znane czynniki ryzyka.
Objawy raka piersi
- guz w obrębie gruczołu piersiowego
- wciągnięcie skóry lub brodawki
- zmiana wielkości lub kształtu piersi
- zmiany skórne wokół brodawki
- wyciek z brodawki (zwłaszcza krwisty)
- zaczerwienienie i zgrubienie skóry („skórka pomarańczowa”)
- powiększenie węzłów chłonnych w dole pachowym
- poszerzenie żył skóry piersi
- owrzodzenie skóry piersi
U około 15% - 25% chorych guz może nie być wyczuwalny, szczególnie u kobiet, u których podejrzane zmiany radiologiczne wykryto podczas cyklicznych badań mammograficznych.
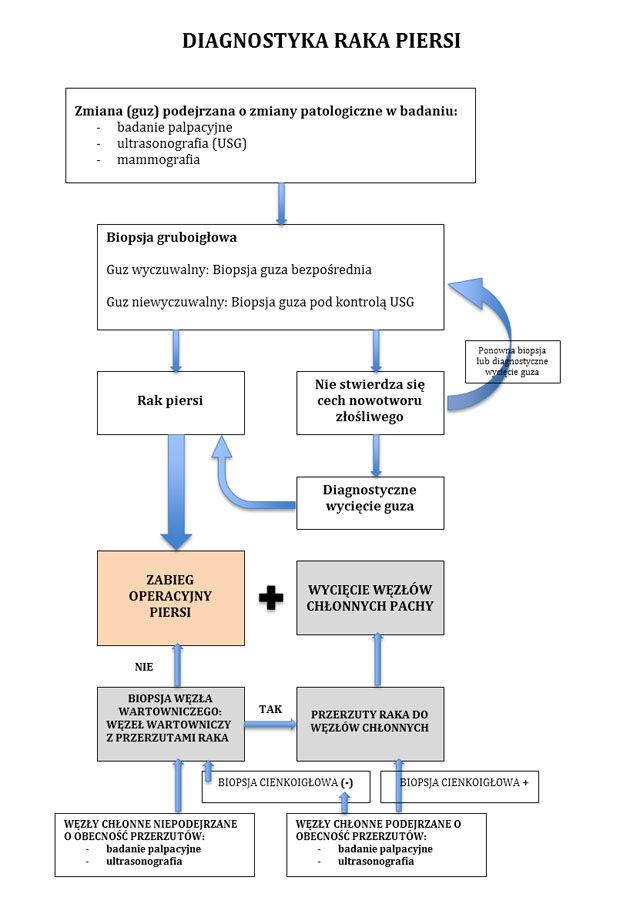
Diagnostyka raka piersi
W celu potwierdzenia bądź wykluczenia raka piersi należy wykonać następujące badania:
- badanie palpacyjne
- mammografia, a w przypadku wycieku treści płynnej z brodawki - galaktografia
- badanie USG piersi i mammografia u kobiet poniżej 35 r.ż.
- biopsję aspiracyjną cienkoigłową (BAC)
- biopsja gruboigłowa
- FDG-PET - tomografia pozytronowa z wykorzystaniem 18-fluorodeoksyglukozy (FDG) jako znacznika (ESMO Guidelines 2020)
Mammografia
Mammografia wykonywana w dwóch projekcjach (górno- dolna i skośna) jest podstawową i najbardziej popularną metodą diagnostyczną piersi. Jest to badanie proste, szybkie, zazwyczaj niebolesne, nie wymaga też żadnego dodatkowego przygotowania. Dawka promieniowania podczas badania jest zbliżona do otrzymywanej podczas prześwietlenia zęba.
Wykonywane zdjęcia muszą spełniać przyjęte standardy jakości – aparatura i inne elementy wyposażenia gabinetu jak i czynności wykonywane przez personel pracowni mammograficznej muszą podlegać stałym procedurom kontroli i ulepszania. Czułość mammografii w wykrywaniu zmian nowotworowych wynosi około 85 proc. i zależy od budowy piersi: mniejsza dla piersi o dużej gęstości, typowej dla kobiet młodszych, może sprawiać problemy diagnostyczne.
Część raków piersi, nawet wyczuwalnych w badaniu palpacyjnym, (pomijając błędy techniczne takie jak nieprawidłowe ułożenie piersi, błąd percepcji błędy interpretacji) jest niewidoczna w obrazie mammograficznym. Zdjęcia oceniane są zazwyczaj przez dwóch radiologów, co pozwala zmniejszyć ryzyko błędu interpretacji.
Badanie mammograficzne pozwala na wykrycie nawet drobnych zmian uwapnionych (mikrozwapnienia), które mogą być ogniskami raka. Ich ocena, czy ich obecność może świadczyć o nowotworze, czy też są to zwapnienia łagodne, należy do radiologa.
Pod kontrolą badania mammograficznego moiżna wykonać biopsję podejrzanej zmiany w piersi. Jeśli można wyznaczyć miejsce biopsji używając namiarów wykonanego badania, to biopsja tak wykonana nosi nazwę: biopsja stereotaktyczna
Ultrasonografia (USG)
Ultrasonografia piersi jest wykorzystywana w ocenie raka piersi jako uzupełniający element pogłębionej diagnostyki podejrzanych o nowotworowe zmian wykrytych podczas mammografii. Metoda ta jest niezwykle cenna do oceny piersi o dużej gęstości gruczołowej – typowych zwłaszcza dla młodych kobiet, przed menopauzą, aktywnych hormonalnie.
W przypadku piersi o budowie bogatogruczołowej, gdy badanie mammograficzne nie jest diagnostyczne (obraz zbitej tkanki gruczołowej, który wygląda jak „mleczna szyba“) badanie USG może być jedynym (poza rezonansem magnetycznym), które pozwala na wykrycie zmian patologicznych.
Poza tym ultrasonografia jest wartościowym uzupełnieniem mammografii w każdej sytuacji – umożliwia różnicowanie zmian torbielowatych i litych, pozwala na precyzyjną ocenę wielkości i granic zmian ogniskowych.
Podczas badania USG pod kontrolą sondy wykonuje się niekiedy biopsje cienko- i gruboigłowe oraz punkcje torbieli a materiał pobrany pozwala na ostateczne różnicowanie mikroskopowe patologii. Badanie z tzw. opcją dopplerowską zwiększa dodatkowo czułość i swoistość USG w różnicowaniu zmian łagodnych i tych podejrzanych o złośliwość.
Na wynik badania wpływ mają zarówno jakość sprzętu, możliwości rozdzielcze aparatów, technika przeprowadzania badania i doświadczenie badającego, jak i różnice w ułożeniu piersi przy kolejnych badaniach. Trudna może być także ocena bardzo dużych piersi.
Elastografia
Elastografia jest nowoczesną techniką badania ultrasonograficznego, polegającą na ocenie elastyczności (twardości) guza. W trakcie badania USG stosuje się niewielki nacisk na pierś, powodujący powstawanie odkształceń widocznych I analizowanych przez aparat ultrasonograficzny. Stopień twardości badanej tkanki określany jest odpowiednim kolorem i oceniany według skali Tsukuba
| Stopień | Kolor w obrazie USG | Stopień twardości | Ocena zmiany |
|---|---|---|---|
| 1 | zielony | miękki | norma |
| 2 | zielono-żółto-czerwony | miękki | zmiana łagodna |
| 3 | niebieski | twardy | podejrzenie złośliwości |
| 4 | niebiesko-zielony | twardy | zmiana złośliwa |
| 5 | niebiesko-zielono-czerwony | twardy-sztywny | zmiana złośliwa, zaawansowana |
Biopsja cienkoigłowa i gruboigłowa - kiedy i po co ją wykonywać?
W arsenale diagnostycznym podstawowym badaniem, stwierdzającym obecność nowotworu złośliwego, przez długie lata była biopsja cienkoigłowa BAC (Biopsja Aspiracyjna Cienkoigłowa). Badanie to jest proste do wykonania, nie wymaga skomplikowanego instrumentarium.
Ale postępy w leczeniu raka piersi wymusiły zmianę podejścia do uzyskiwania materiału diagnostycznego. Biopsja cienkoigłowa dawała jedynie możliwość oceny poszczególnych komórek (badanie cytologiczne), ale już nie tkanki nowotworowej. A to właśnie ocena tkanki daje możliwość odpowiedzi na pytanie o stopień złośliwości nowotworu, typ histologiczny, różnicowanie pomiędzy nowotworem w stadium przedinwazyjnym (in-situ) a stadium inwazyjnym.
W przeciwieństwie do BAC, biopsja gruboigłowa pozwala także na ocenę czynników prognostycznych i tych wpływających na wybór sposobu leczenia (receptory estrogenowe, receptory progesteronowe, receptory HER-2 i Ki-67). Różnicę w ocenie materiału pobranego w trakcie biopsji cienkoigłowej i gruboigłowej ilustrują wyniki badań (Fot. 1 - biopsja cienkoigłowa, Fot. 2 - biopsja gruboigłowa).
Do podjęcia decyzji o leczeniu standardem w chwili obecnej jest wykonanie biopsji gruboigłowej, a nie cienkoigłowej. Ta ostatnia służy obecnie do oceny obecności komórek nowotworowych w węzłach chłonnych pachy lub obszaru nadobojczykowego oraz do oceny wznowy miejscowej raka. Ma zastosowanie także w podejrzeniu zmian nienowotworowych, takich jak torbiele.
Bardziej nowoczesną metodą jest biopsja gruboigłowa wspomagana próżnią. Metoda polega na wkłuciu igły w podejrzany obszar tkanki piersi i zassanie jej do specjalnego rowka w igle. Następnie element zewnętrzny igły ścina fragment tkanki, który zostaje pobrany do badania. Metoda ta zwiększa prawdopodobieństwo uzyskania odpowiedniego fragmentu tkanki, bez ponownej konieczności przeprowadzania biopsji.
Rezonans magnetyczny (MRI)
Badanie rezonansu magnetycznego, dzięki bardzo dobrej rozdzielczości tkankowej przestrzennej i czasowej, pozwala na niezwykle dokładne obrazowanie morfologii piersi, zaburzeń ich architektury i wykrycie najmniejszych patologii – jest najbardziej czułym badaniem, bardziej czułym niż mammografia i usg.
Standardem MRI jest jednoczesne badanie obu piersi, po dożylnym podaniu paramagnetycznego środka kontrastującego. Czułość metody w wykrywaniu inwazyjnego raka piersi wynosi ponad 98 proc., a swoistość 90–95 proc. Czułość jest większa gdy badanie wykonywane jest między 6. a 13. dniem cyklu u kobiet przed menopauzą, lub co najmniej cztery tygodnie po odstawieniu hormonalnej terapii zastępczej u kobiet starszych.
Badanie zalecane jest wśród kobiet zakwalifikowanych do leczenia oszczędzającego inwazyjnych raków piersi jeśli pomiary guza w badaniach mammograficznych i ultrasonografii znacznie się różnią. Poza tym w razie przedoperacyjnie postawionego rozpoznania carcinoma occultum (obecność klinicznych przerzutów do pachowych węzłów chłonnych bez wykrycia guza pierwotnego w piersi w badaniu klinicznym, mammografii i USG) pozwala niekiedy zlokalizować zmianę rakową jeśli do tej pory ognisko pierwotne było nieznane.
Rezonans magnetyczny służy również – z uwagi na swoją wysoką czułość i możliwość diagnozowania bardzo wczesnych zmian – jako badania przesiewowe w grupie kobiet z wysokim ryzykiem zachorowania na raka piersi: u nosicieli mutacji rodzinnych w kierunku raka piersi, jednak bez potwierdzonej w badaniach molekularnych mutacji, po wcześniejszym leczeniu onkologicznym – radioterapii – na obszar klatki piersiowej wykonanym w młodszym wieku, z innych wskazań medycznych.
Poza tymi wskazaniami, badanie wykonuje się u kobiet po wcześniejszych interwencjach chirurgicznych w obrębie piersi, po leczeniu oszczędzającym z powodu raka piersi, jeżeli wyniki badań klasycznych są niejednoznaczne, a nie można wykonać biopsji lub wynik biopsji jest niejednoznaczny. Po zabiegach operacyjnych powiększenia estetycznego czy rekonstrukcji piersi, celem diagnostyki profilaktycznej również lepszą czułością cechuje się rezonans magnetyczny. Jest to ważne zwłaszcza w przypadku podejrzenia pęknięcia implantu czy w przypadku klinicznego podejrzenia wznowy w rekonstruowanej piersi.
Historia wcześniejszego leczenia raka piersi, jeżeli wyniki konwencjonalnych badań są ujemne lub niejednoznaczne, zawsze narzuca konieczność weryfikacji w badaniu MRI, z uwagi na zdecydowanie większą czułość i swoistość badania.
Schemat diagnostyki raka piersi:
Klasyfikacja i ocena stopnia zaawansowania raka piersi
Klasyfikacja histologiczna raka piersi
I. Raki nienaciekające: (stanowią około 15% wszystkich raków piersi)
- rak wewnątrzprzewodowy (carcinoma intraductale in situ – CDIS)
- rak wewnątrzzrazikowy (carcinoma lobulare in situ – CLIS)
II. Raki naciekające
- rak przewodowy naciekający (carcinoma ductale infiltrans)
- rak zrazikowy naciekający (carcinoma lobulare infiltrans)
- rak galaretowaty (carcinoma gelatinosum)
- rak rdzeniasty (carcinoma medullare)
- rak brodawkowaty (carcinoma papillare)
- rak cewkowaty (carcinoma tubulare)
- rak gruczołowo-torbielowaty (carcinoma adenoides cysticum)
- rak apokrynalny (carcinoma apocrinale)
- rak z metaplazją (carcinoma c. metaplasia)
| CDIS | LCIS | |
|---|---|---|
| Występowanie | Objawowe 3% - 4%, Skrining 17% | Objawowe 0,5%, Skrining 1% |
| Zwapnienia widoczne w badaniu mammograficznym | Obecne zwłaszcza w typie comedo, w innych podtypach występują rzadziej | Często nieobecne |
| Podtypy | Comedo, Cribriforme, Papillare, Micropapillare, Solidum | Solidum |
| Ryzyko wystąpienia raka inwazyjnego | 30% - w tej samej piersi w ciągu 10 – 18 lat | 15-20% w tej samej piersi, 10-15% w drugiej piersi |
| Leczenie | Mastectomia lub BCT | Mastectomia/BCT |
Klasyfikacja TNM raka piersi (8. edycja UICC):
| T (tumor) - guz pierwotny nowotworu | |
|---|---|
| Tx | nie można ocenić guza pierwotnego |
| T0 | nie stwierdza się guza pierwotnego |
| Tis | rak przedinwazyjny (in situ) |
| Tis (DCIS) | rak przewodowy in situ |
| Tis (LCIS) | rak zrazikowy in situ |
| Tis (Paget) | choroba Pageta brodawki sutkowej nie związana z rakiem inwazyjnym lub/i z rakiem in-situ (DCIS lub/i LCIS) w głebiej leżącej tkance gruczołowej |
| T1 | guz nie większy niż 2 cm |
| T1mi | guz nie większy niż 0,1 cm (mikronaciekanie) |
| T1a | guz większy niż 0,1 cm ale nie większy niż 0,5 cm |
| T1b | guz większy niż 0,5 cm ale nie większy niż 1 cm |
| T1c | guz większy niż 1 cm ale nie większy niż 2 cm |
| T2 | guz większy niż 2 cm ale nie większy niż 5 cm |
| T3 | guz większy niż 5 cm |
| T4 | guz każdej wielkości naciekający ścianę klatki piersiowej i/lub skórę (owrzodzenie lub guzki satelitarne skóry) |
| T4a | naciekanie ściany klatki piersiowej (żebra, mięśnie międzyżebrowe, mięsień zębaty przedni) lecz nie mięśni piersiowych |
| T4b | owrzodzenie, guzki satelitarne lub obrzęk skóry (nie spełniające kryteriów raka zapalnego) |
| T4c | T4a i T4b jednocześnie |
| T4d | rak zapalny (carcinoma inflamatorium) |
| N (lymph nodes) - stan regionalnych węzłów chłonnych | |
|---|---|
| Nx | nie można ocenić okolicznych węzłów chłonnych |
| N0 | brak przerzutów do regionalnych węzłów chłonnych |
| N1 | przerzuty w ruchomych węzłach chłonnych I–II piętra pachy po stronie guza |
| N2 | przerzuty w klinicznie nieruchomych lub tworzących pakiet węzłach chłonnych I–II piętra pachy po stronie guza lub stwierdzone klinicznie przerzuty w węzłach piersiowych wewnętrznych po tej samej stronie, przy braku klinicznie podejrzanych węzłów pachowych |
| N2a | przerzuty w klinicznie nieruchomych lub tworzących pakiety węzłach chłonnych I–II piętra pachy po stronie guza |
| N2b | stwierdzone klinicznie przerzuty w węzłach piersiowych wewnętrznych po stronie guza przy braku klinicznie podejrzanych węzłów pachowych |
| N3 | przerzuty w węzłach (węźle) podobojczykowych po stronie guza (III piętro pachy) z zajęciem lub bez zajęcia węzłów pięter I i II; stwierdzone klinicznie przerzuty w węzłach (węźle) piersiowych wewnętrznych po stronie guza przy jednoznacznie klinicznie zmienionych węzłach piętra I i II pachy; przerzuty w węzłach (węźle) nadobojczykowych po stronie guza z zajęciem lub bez zajęcia węzłów chłonnych pachy lub piersiowych wewnętrznych |
| N3a | przerzuty w węzłach podobojczykowych po stronie guza |
| N3b | przerzuty w węzłach piersiowych wewnętrznych i w węzłach pachowych |
| N3c | przerzuty w węzłach nadobojczykowych po stronie guza |
| pN (lymph nodes) - stan węzłów chłonnych - klasyfikacja patologiczna | ||
|---|---|---|
| pNx | nie ma możliwości oceny węzłów chłonnych | |
| pN0 | nie ma przerzutów do regionalnych węzłów chłonnych | |
| pN0(i-) | Nie stwierdzono przerzutów do regionalnych węzłów chłonnych w badaniu histologicznym czy morfologicznym na obecność ITC (isolated tumor cells) | |
| pN0(i+) | Nie stwierdzono przerzutów do regionalnych węzłów chłonnych w badaniu histologicznym, stwierdzono komórki nowotworowe w badaniu morfologicznym ITC | |
| pN0(mol-) | Nie stwierdzono przerzutów do regionalnych węzłów chłonnych w badaniu histologicznym czy molekularnym | |
| pN0(mol+) | Nie stwierdzono przerzutów do regionalnych węzłów chłonnych w badaniu histologicznym, wynik badania molekularnego pozytywny (obecność nowotworu) | |
| pN1 | Mikroprzerzuty lub przerzuty w 1 do 3 pachowych węzłach chłonnych i/lub przerzuty w węzłach chłonnych piersiowych wewnętrznych | |
| pN1mi | mikroprzerzuty (większe niż 0,2 mm i/lub > 200 komórek, ale żaden nie większy niż 2mm) | |
| pN1a | przerzuty w 1–3 pachowych węzłach chłonnych (w tym w co najmniej jeden większy niż 2 mm) | |
| pN1b | przerzuty w węzłach chłonnych piersiowych wewnętrznych | |
| pN1c | przerzuty w 1–3 pachowych węzłach chłonnych i węzłach chłonnych piersiowych wewnętrznych | |
| pN2 | przerzuty w 4–9 pachowych węzłach chłonnych lub przerzuty w węzłach chłonnych piersiowych wewnętrznych przy braku przerzutów w pachowych węzłach chłonnych | |
| pN2a | przerzuty w 4–9 pachowych węzłach chłonnych (w tym w co najmniej jeden > 2 mm) | |
| pN2b | przerzuty w węzłach chłonnych piersiowych wewnętrznych przy braku przerzutów w pachowych węzłach chłonnych | |
| pN3 | przerzuty w 10 lub więcej pachowych węzłach chłonnych lub przerzuty w podobojczykowych węzłach chłonnych lub pN3b lub przerzuty w nadobojczykowych węzłach chłonnych | |
| pN3a | przerzuty w 10 lub więcej pachowych węzłach chłonnych, w tym w co najmniej jeden > 2 mm lub przerzuty w podobojczykowych węzłach chłonnych (III piętro dołu pachowego) | |
| pN3b | Przerzuty wykryte klinicznie w węźle/węzłach chłonnych piersiowych wewnętrznych po stronie guza z obecnością przerzutów do węzła/węzłów chłonnych pachowych; lub przerzuty w więcej niż 3 węzłach chłonnych pachowych i w węzłach chłonnych piersiowych wewnętrznych (mikroprzerzuty lub makroprzerzuty) wykryte za pomocą biopsji węzła wartowniczego, bez klinicznych cech przerzutów | |
| pN3c | przerzuty w nadobojczykowych węzłach chłonnych | |
| M (metastases) - przerzuty odległe | |
|---|---|
| M0 | nie stwierdza się obecności przerzutów odległych |
| cM0(i+) | Komórki raka wykryte mikroskopowo bądź technikami biologii molekularnej we krwi, innych tkankach lub pozaregionalnych węzłach chłonnych (depozyt ≤ 0,2 mm lub ≤ 200 komórek), przy braku innych objawów przerzutów |
| M1 | Obecne przerzuty odległe |
Stopnień zaawansowania (ang. staging) raka piersi (aktualizacja 01/2018)
| Stopień zaawansowania raka piersi określony na podstawie klasyfikacji TNM | |
|---|---|
| Stopień 0 | Tis N0 M0 |
| Stopień IA | T1 N0 M0 |
| Stopień IB | T0,T1 N1mi M0 |
| Stopień IIA | T0,T1 N1 M0 |
| T2 N0 M0 | |
| Stopień IIB | T2 N1 M0 |
| T3 N0 M0 | |
| Stopień IIIA | T0,T1,T2 N2 M0 |
| T3 N1,N2 M0 | |
| Stopień IIIB | T4 N0,N1,N2 M0 |
| Stopień IIIC | każdy T N3 M0 |
| Stopień IV | każdy T każdy N M1 |
Czynniki prognostyczne
Zasadniczym kryterium prognostycznym w raku piersi jest zaawansowanie wg klasyfikacji TNM. Najsilniejszym czynnikiem rokowniczym jest stan regionalnych węzłów chłonnych. Wielkość guza jest ściśle związana z prawdopodobieństwem wystąpienia wznowy guza, obecnością przerzutów do węzłów chłonnych i zgonu. Cechą korzystną rokowniczo jest obecność receptorów estrogenowych i progesteronowych. Do innych czynników należy typ histologiczny, stopień złośliwości histologicznej wg skali Richardsona-Bloom’a. Żaden czynnik, zarówno rozpatrywany pojedyńczo jak i w powiązaniu z innymi nie jest w stanie dokładnie określić przebiegu choroby.
W badaniach klinicznych ocenia się także inne czynniki, o różnej wartości rokowniczej: protoonkogeny, onkogeny, geny supresorowe orz ich produkty: EGFR, c-erbB-2, c-myc, ps2, p53, MDR-1, BRCA-1, BRCA-2, markery aktywności proliferacyjnej guza: indeks mitotyczny (MI), indeks znakowanej tymidyny (TLI), frakcja komórek w fazie S (SPF), PCNA, Ki-67; ploidia DNA, markery angiogenezy; markery wysokiego ryzyka przerzutowania: katepsyna-D, nm-23, aktywator plazminogenu (UPA)
7. Leczenie raka piersi
7.1 Leczenie chirurgiczne raka piersi - wprowadzenie
Do leczenia chirurgicznego kwalifikują się chore w I i II stopniu zaawansowania klinicznego. Najczęściej wykonywanym zabiegiem jest zmodyfikowana amputacja piersi sposobem Patey’a (wycięcie gruczołu piersiowego wraz z węzłami chłonnymi pachy, bez usuwania mięśni piersiowych).
Część chorych kwalifikuje się do leczenia oszczędzającego pierś. Możliwość taka istnieje w następujących przypadkach:
- TisN0M0
- T1N0M0
- T1N1M0
- T2N0-1M0 (guz nie większy niż 2 cm w wymiarze mammograficznym)
- możliwość wycięcia guza z marginesem tkanek zdrowych
- przewidywany dobry efekt kosmetyczny
- zgoda pacjentki na leczenie oszczędzające
- brak przeciwwskazań (patrz poniżej)
Przeciwwskazania bezwzględne do leczenia oszczędzającego:
- rak wieloośrodkowy
- wznowa raka po uprzednim leczeniu oszczędzającym
- uprzednio przebyte napromienianie piersi
- brak możliwości uzyskania marginesu tkanek zdrowych wokół guza
Przeciwwskazania względne:
- ciąża
- przewidywany zły efekt kosmetyczny
- choroby układowe (kolagenozy)
7.2 Leczenie oszczędzające (BCT – Breast Conserving Treatment)
Leczenie oszczędzające pierś (BCT) polega na wycięciu guza nowotworowego w granicach tkanek zdrowych oraz regionalnych węzłów chłonnych pachy.
Wyróżnia się następujące sposoby wycięcia guza nowotworowego piersi:
- kwadrantektomia/segmentektomia (ang. tylectomy) – guz usunięty z marginesem przynajmniej 2 cm. Jeżeli margines od strony mięśni jest mniejszy niż 1 cm to należy guz usunąć wraz z powięzią
- lumpektomia (ang wide excision, lumpectomy) – wycięcie guza z 1 cm marginesem makroskopowo niezmienionych tkanek. Margines ten od strony mięśni może być mniejszy, ale należy wówczas usunąć powięź.
- tumorektomia (ang excisional biopsy, tumorectomy) – wycięcie guza bez marginesu, ale z intencją usunięcia wszystkich makroskopowo podejrzanych tkanek
Uwaga: optymalnym marginesem jest 1 cm. Należy pamiętać, że wraz ze zmniejszaniem marginesu poprawia się efekt kosmetyczny, ale zwiększa się możliwość powstania wznowy miejscowej.
Ocena marginesu wycięcia tkanki gruczołu piersiowego z guzem jest niezmiernie ważnym elementem leczenia oszczędzającego pierś. Jeśli guz nowotworowy otoczony jest zdrową tkanką, to określamy to jako „margines ujemny“ (t.zn. nie zawierający komórek nowotworowych). Jeśli w marginesie odcięcia są obecne komórki nowotworowe, to margines ten nazywamy „dodatnim“. Świadczy on o nieradykalnym (niecałkowitym) wycięciu guza nowotworowego i wymaga poszerzenia zabiegu o docięcie marginesu tkankowego lub nawet wykonania całkowitej amputacji gruczołu piersiowego.
Radioterapia uzupełniająca po zabiegu BCT – podawane są wszystkie chore. Gruczoł piersiowy jest napromieniany dawką całkowitą 50 Gy we frakcjach po 2 Gy (25 frakcji – w ciągu 5 tygodni). Dodatkowo lożę po wyciętym guzie napromienia się metodą afterloading 192Ir dawką 10 Gy.
Marker chirurgiczny wspomagający leczenie oszczędzające w raku piersi
Współczesne leczenie raka piersi ukierunkowane jest na zachowanie piersi. Obecnie, również w sytuacjach, gdzie dotychczas nie było możliwe wykonanie zabiegów oszczędzających, można uzyskać warunki do ich przeprowadzenia. W sytuacji, gdy zaawansowanie miejscowe guza nie pozwala na wykonanie zabiegu oszczędzającego, możliwe jest zastosowanie leczenia wstępnego (adjuwantowego), opartego zazwyczaj na chemioterapii.
W wyniku takiego postępowania może dojść do zmniejszenia wielkości guza, a nawet do jego całkowitego zaniku. W tej sytuacji niezwykle ważne jest wcześniejsze oznaczenia miejsca, w którym pierwotnie znajdował się guz, tak aby możliwe było wycięcie tkanek w tej okolicy. Film pokazuje technikę implantacji markera, służącego do identyfikacji umiejscowienia guza.
Leczenie oszczędzające pierś (BCT) - opis zabiegu
Zabiegi operacyjne oszczędzające pierś są wykonywane w przypadku bezpiecznej możliwości wycięcia jedynie guza wraz z marginesem 1-2 cm tkanek zdrowych, bez potrzeby usuwania całej piersi. Gdy spodziewany efekt kosmetyczny będzie zadowalający. Wykonuje się je w przypadku guzów o średnicy do 2-3 cm, z uwzględnieniem wielkości piersi - im większa pierś, tym większa możliwość wykonania zabiegu oszczędzającego.
W przypadku guzów wcześnie wykrytych za pomocą badań przesiewowych, nie wyczuwalnych badaniem ręcznym (badanie palpacyjne) konieczne jest ich umiejscowienie przed zabiegiem operacyjnym za pomocą mammografii lub badania ultrasonograficznego (USG). Po uwidocznieniu guza, pod kontrolą mammografii lub USG, w znieczuleniu miejscowym, wkłuwa się w to miejsce igłę, przez którą wprowadza się metalowy drut zakończony "kotwiczką". Po wprowadzeniu "kotwiczki" umiejscowienie w guzie potwierdza się wykonując ponownie badanie obrazowe (mammografia lub USG). "Kotwiczka" zostaje na miejscu do czasu zabiegu operacyjnego. Po nacięciu skóry wycina się fragment gruczołu piersiowego prowadząc cięcie w odpowiedniej odległości od "kotwiczki".
Warunkiem wycięcia radykalnego jest wycięcie podejrzanej zmiany bez jej przecięcia w trakcie preparowania wraz z marginesem tkanek zdrowych. Bezpośrednio po wycięciu fragmentu piersi z guzem oznacza się marginesy wycięcia (górny, dolny, boczny, przyśrodkowy, podstawny). Po wykonaniu badania histopatologicznego, gdy któryś z marginesów jest nacieczony przez nowotwór, wiadomo, z którego obszaru piersi należy dociąć dodatkowy margines, bez konieczności wykonywania amputacji piersi.
Lożę (tj. otwór w gruczole piersiowym) po wyciętym guzie należy sprawdzić czy nie ma krwawienia i zaszyć z pozostawieniem drenu. W przypadku loży dużych rozmiarów, w dużej piersi, można wykonać dodatkowo plastykę tkanek, polegającą na przesunięciu części gruczołu piersiowego przylegającego do loży, tak by zmniejszyć powierzchnię krwawienia. Ranę zaszywa się szwami pojedynczymi niewchłanianymi lub szwem ciągłym, kosmetycznym, wchłanialnym bądź niewchłanialnym.
Jeśli nowotwór okaże się rakiem nieinwazyjnym (rak wczesny nienaciekający, rak in-situ, carcinoma in-situ) nie ma zazwyczaj potrzeby wykonywania uzupełniającej radioterapii. Jedynie w przypadku raków in-situ o dużych rozmiarach lub mających potencjalnie dużą możliwość zezłośliwienia wskazane może być uzupełnienie zabiegu o radioterapię.
W przypadku każdego raka inwazyjnego (carcinoma invasivum) należy zabieg oszczędzający pierś uzupełnić o radioterapię. Możliwe jest także wykonanie dodatkowo radioterapii miejscowej (brachyterapia). Prowadnice (cienkie rurki, przez które będą wprowadzone kulki z materiałem promieniotwórczym) zakłada się w trakcie zabiegu operacyjnego po zeszyciu tkanek. Brachyterapia wykonywana jest w dniu następnym. Nie jest to alternatywa dla radioterapii uzupełniającej, lecz jej uzupełnienie.
Możliwości wykonania zabiegu oszczędzającego w raku piersi
Wskazania (możliwości) do leczenia oszczędzającego w raku piersi:
- Świadoma zgoda pacjentki po uzyskaniu wyczerpujących informacji od lekarza
- Średnica guza w badaniu obrazowym (mammografia, USG) < 3 cm (T1a,T1b,T1c,T2(<3 cm), brak przerzutów do węzłów chłonnych (N0) lub przerzuty pojedyncze (N1)
- Możliwość wykonania zabiegu doszczętnego (wycięcie całej masy guza z marginesem tkanek zdrowych)
- Bardzo dobry lub dobry efekt kosmetyczny (stosunek wielkości guza do wielkości piersi)
Przeciwwskazania do leczenia oszczędzającego w raku piersi:
- Mutacja genu BRCA1, BRCA2
- Wcześniejsza radioterapia w obrębie piersi
- Rak wieloogniskowy (liczne zmiany w obrębie jednego kwadrantu) lub wieloośrodkowy (ogniska raka w więcej niż jednym kwadrancie)
- Liczne, rozległe mikrozwapnienia w badaniu mammograficznym
- Współistniejące choroby układowe (kolagenozy)
- Brak możliwości wykonania miejscowo radykalnego wycięcia masy guza z marginesem tkanek zdrowych
- Guz > 3 cm
7.2.1 Biopsja węzła wartowniczego
Czy można nie usuwać węzłów chłonnych pachy i nie narażać w ten sposób chorej na raka piersi na obrzęk chłonny ręki?
Nowoczesne, jak najmniej inwazyjne, leczenie raka piersi jest możliwe we wczesnych przypadkach. Stąd tak ważne są wszelkie formy badań mających na celu jak najszybsze wykrycie zmian patologicznych w piersiach. Jeśli wykryta zmiana jest widoczna tylko w badaniu obrazowym (badanie ultrasonograficzne, badanie mammograficzne) możliwe są zazwyczaj wszelkie formy skutecznego leczenia oszczędzającego pierś.
Ważne jest nie tylko samo zaoszczędzenie piersi. Z punktu widzenia możliwych powikłań po zabiegu operacyjnym jednym z najważniejszych zagadnień jest możliwość zaoszczędzenia tkanek pachy i nie usuwania wszystkich węzłów chłonnych z tego obszaru. Jednakże jest to możliwe wyłącznie, gdy węzły chłonne pachy nie są wyczuwalne w badaniu ręcznym i nie ma podejrzenia, w badaniu ultrasonograficznym, że mogą być zmienione przez przerzuty . Im wcześniej wykryta zmiana, tym większe prawdopodobieństwo, że nie ma przerzutów do węzłów chłonnych.
Metodą pozwalającą na ocenę stanu regionalnych węzłów chłonnych jest tzw. Biopsja węzłów wartowniczych. Węzeł wartowniczy to ten, który jest pierwszym na drodze naczynia chłonnego (limfatycznego) biegnącego od strony guza. Nie musi to być wcale węzeł leżący najbliżej guza, stąd konieczność jego rzetelnej oceny, że jest to ten, a nie inny, węzeł chłonny. » czytaj więcej
7.3 Amputacja piersi wraz z regionalnymi węzłami chłonnymi pachy bez przecięcia mięśnia piersiowego mniejszego (amputacja sposobem Maddena) lub z jego przecięciem (amputacja sposobem Patey'a) - opis
W przypadku, gdy nie ma możliwości zaoszczędzenia gruczołu piersiowego (duży guz, lub guz niewspółmierny do wielkości piersi, gdy efekt kosmetyczny zabiegu oszczędzającego byłby zły, lub gdy taka jest wola pacjentki) należy wykonać całkowitą amputację piersi.
Wykonuje się najczęściej cięcie wrzecionowate, okalające pierś. Preparując nożem lub elektrokoagulacją (cięcie elektrodą emitującą ciepło) odcina się gruczoł piersiowy od fałdów skórnych. Od strony mięśni piersiowych usuwa się omięsną ( błona pokrywająca mięsień i stanowiąca naturalną barierę rozprzestrzeniania się nowotworu w tym kierunku). Wypreparowany gruczoł piersiowy jest usuwany.
Z dołu pachowego usuwa się zawartość tłuszczowo-węzłową, z zaoszczędzeniem nerwu piersiowego długiego i pęczka naczyniowo-nerwowego piersiowo-grzbietowego. Jego przecięcie powoduje odstawanie łopatki. W trakcie preparowania pachy przecina się nerwy skórne, stąd znieczulica ( brak czucia) skóry okolicy pachowej i wewnętrznej części ramienia. Znieczulica ta cofa się w czasie w pewnym zakresie, ale objaw ten pozostaje.
Przecięcie naczyń chłonnych (naczynia limfatyczne) powoduje wyciekanie chłonki, co wymaga w okresie pooperacyjnym albo utrzymywania drenu, albo częstego nakłuwania pachy. Okres chłonotoku (nadmiernego gromadzenia się chłonki) może trwać tydzień, ale może też utrzymywać się nawet do 3 miesięcy, co grozi wytworzeniem się torbieli chłonnej, wymagającej w skrajnych przypadkach interwencji chirurgicznej.
Po kontroli, czy nie ma krwawienia z przeciętych naczyń, zeszywa się skórę i tkankę podskórną szwami pojedynczymi lub szwem ciągłym.
7.4 Możliwości rekonstrukcji piersi po wykonaniu całkowitej amputacji piersi sposobem Maddena (Patey'a)
Bezpośrednio po amputacji piersi z wycięciem skóry i tkanki podskórnej można odtworzyć pierś wykonując jej rekonstrukcję z użyciem tkanek własnych, takich jak mięsień prosty brzucha wraz z tkanką podskórną i skórą lub mięsień najszerszy grzbietu wraz z tkanką podskórną i skórą.
Każdy z tych płatów wymaga unaczynienia, stąd taki przemieszczony płat ma swoją szypułę naczyniową. Kwalifikując do takiego zabiegu pacjentki należy pamiętać o tym, że ukrwienie przemieszczonego płata może być zaburzone w przypadku niewydolnych naczyń tętniczych, jak to ma często miejsce u osób nałogowo palących papierosy. Kwalifikując takie pacjentki, należy bezwzględnie przestrzegać czasu przynajmniej 3 miesięcy nie palenia.
Zabiegi z przemieszczeniem tkanek własnych są związane z plastyką tkanek w miejscu, skąd je wycięto. Związane to jest z koniecznością zeszycia skóry i wytworzenia blizny (albo na grzbiecie albo na brzuchu). W przypadku pobrania tkanek z brzucha konieczne jest wszczepienie siatki przeciwprzepuklinowej, gdyż zmniejszona jest wytrzymałość ściany jamy brzusznej. Należy bezwzględnie przestrzegać warunków aseptyki ( nienarażania na kontakt z bakteriami chorobotwórczymi) gdyż zropienie rany po zabiegach plastycznych zawsze powoduje duże ubytki tkankowe i brzydkie blizny.
W terminie odroczonym, tzn. nie jednoczasowo z zabiegiem amputacji piersi, pierś można odtworzyć metodą opisaną powyżej, albo z użyciem protez piersiowych, które wszczepia się zazwyczaj pod mięsień piersiowy. Ze względu na to, że po całkowitej amputacji piersi nie ma nadmiaru skóry, który mógłby formować pierś, należ go wytworzyć. W tym celu pod mięsień piersiowy lub skórę wszczepia się protezę, której objętość (wielkość) można okresowo zwiększać. Taka proteza nosi nazwę ekspandera ( proteza rozciągająca). Po wytworzeniu nadmiaru skóry ( trwa to różnie długo, w zależności od tego, jak duża ma być odtworzona pierś) na miejsce ekspandera wprowadza się protezę ostateczną.
Często, po rekonstrukcji jednej piersi, druga różni się od tej odtworzonej. Ich wielkość i kształt można wyrównać wykonując zabieg podniesienia drugiej piersi (tzw. mastopexia) lub wszczepiają protezę po gruczoł piersiowy lub pod mięsień piersiowy piersi zdrowej.
7.5 Amputacja prosta piersi (amputatio simplex mammae)
Jest to taka sama amputacja, jak całkowita amputacja piersi, ale bez wycięcia węzłów chłonnych pachy. Dotyczy tylko usunięcia samego gruczołu piersiowego. Wykonuje się ją wówczas, gdy pierwotnie guz był dużych rozmiarów i kwalifikował się do wstępnej chemioterapii, mającej na celu uzyskanie zmniejszenia masy guza ( tzw. chemioterapia indukcyjna ).
Po zmniejszeniu guza możliwe jest wykonanie amputacji, ale ze względu na pierwotny stopień zaawansowania i odpowiedź na chemoterapię nie ma uzasadnienia usuwanie regionalnych węzłów chłonnych.
Innym wskazaniem do wykonania amputacji prostej jest sytuacja, gdy po wykonaniu zabiegu oszczędzającego pierś i wycięciu węzła wartowniczego badanie histopatologiczne wykazało brak obecności przerzutów do węzła ( czyli nie ma potrzeby wykonywania wycięcia wszystkich węzłów z pachy), ale w otoczeniu guza i w tkance gruczołowej stanowiącej margines tkanek otaczających guz stwierdzono dodatkowe ogniska nowotworu lub zatory z komórek nowotworowych w naczyniach chłonnych bądź krwionośnych. Wówczas należy wyciąć dodatkowy margines tkanek. Jeśli nie jest to możliwe ze względu na rozległość tych dodatkowych zmian nowotworowych lub wielkość piersi nie pozwala na uzyskanie dobrego efektu kosmetycznego, należy wykonać amputację prostą.
7.6 Leczenie neoadjuwantowe (indukcyjne) raka piersi
Leczenie neoadjuwantowe (indukcyjne) w raku piersi ma na celu poprawę wyników leczenia poprzez likwidację komórek nowotworowych w guzie piersi przed zaplanowanym następnie zabiegiem operacyjnym. Leczenie neoadjuwantowe może być oparte o chemioterapię systemową, ale coraz częściej także o hormonoterapię, gdy w badaniu histopatologicznym z biopsji gruboigłowej występują receptory estrogenowe (receptory estrogenowe dodatnie).
Leczenie to, poza poprawą wyników leczenia, pozwala niejednokrotnie na wykonanie zabiegu oszczędzającego pierś, nawet jeśli przed tym leczeniem nie było takiej możliwości.
W celu oceny odpowiedzi na leczenie, patolog po zabiegu operacyjnym ocenia zmiany, które się dokonały w guzie nowotworowym. Stopień tych zmian (stopień remisji) można ocenić różnymi klasyfikacjami, jak np. klasyfikacją Chevalklier’a (Tab. 1) lub Sataloff (Tab. 2).
| 1 | brak komórek nowotworowych w piersi i brak przerzutów do węzłów chłonnych |
| 2 | obecność raka in situ w piersi |
| 3 | obecność przetrwałych komórek raka inwazyjnego ze zmianami w podścielisku (sklerotyzacja, zwłóknienie) |
| 4 | niewielki efekt lub brak efektu terapeutycznego |
| T (tumor) - guz | |
|---|---|
| T - A | Całkowita lub prawie całkowita odpowiedź na leczenie |
| T - B | Efekt leczniczy większy niż 50% ale nie całkowity |
| T - C | Efekt leczniczy mniejszy niż 50% |
| T - D | Brak efektu leczniczego |
| N (nodal) - węzły chłonne | |
| N - A | Całkowity efekt leczniczy, brak przetrwałych komórek nowotworowych |
| N - B | Efekt leczniczy niewidoczny, ale brak przerzutów do węzłów |
| N - C | Widoczny efekt leczniczy ale obecne przetrwałe komórki nowotworowe |
| N - D | Żywe komórki nowotworowe, brak efektu leczniczego |
7.7 Leczenie uzupełniające po zabiegu radykalnym (BCT, Mastektomia sposobem Patey’a)
Radioterapia uzupełniająca – wskazania:
- przerzuty w więcej niż 4 węzłach chłonnych
- pT powyżej 5 cm
- komórki nowotworowe w linii cięcia
Obszar napromieniany: pacha, okolica nadobojczykowa, ściana klatki piersiowej, mostek. U chorych po BCT napromienia się pachę, jeśli stwierdza się przerzuty w więcej niż 4 węzłach chłonnych. Uwaga: Napromienianie przeprowadza się po zakończeniu chemioterapii.
Powikłania po radioterapii
Usunięcie całej regionalnej grupy węzłów chłonnych pachy (zabieg: limfadenektomia pachowa) może doprowadzić do obrzęku kończyny. Powikłanie to może wystąpić zarówno jako wczesne (w krótkim okresie po zabiegu) jak i późne (wiele miesięcy a nawet lat po zabiegu). Obrzęki te nie są zazwyczaj dużego stopnia i rzadko wpływają negatywnie na normalne funkcjonowanie pacjenta.
Inna sytuacja powstaje w przypadku obecności przerzutów do regionalnych węzłów chłonnych z naciekaniem torebki węzła lub gdy obecne są przerzuty w licznych węzłach. W takim stopniu zaawansowania konieczne jest uzupełnienie zabiegu wycięcia węzłów chłonnych o dodatkowe leczenia, jakim jest radioterapia. Jest ona stosowana na obszar dołu pachowego i jest zwiększonym czynnikiem ryzyka poważnych powikłań obrzękowych. Ocenia się, że w takiej sytuacji klinicznej obrzęk chłonny może wystąpić nawet u 40% pacjentów.
Do powikłań związanych z radioterapią należy także uszkodzenia popromienne skóry i tkanki podskórnej. W celu ochrony skóry stosuje się odpowiednie maści i kremy, a także delikatnie utrzymuje się czystość uszkodzonej skóry, bez jej drażnienia i powodowania dodatkowych urazów.
Leczenie uzupełniające – wskazania:
Wszystkie chore z przerzutami do węzłów chłonnych (pN1)
Chore bez przerzutów do węzłów kwalifikuje się do jednej z 3 grup rokowniczych: o rokowaniu dobrym, pośrednim i złym:
| Rokowanie dobre: - guz poniżej 1 cm - I0 złośliwości wg Bloom’a - ER (+) lub PR (+) - wiek powyżej 35 lat | Rokowanie pośrednie: - guz 1 – 2 cm - I0 lub II0 złośliwości wg Bloom’a - ER (+) lub ER (+) | Rokowanie złe: - powyżej 2 cm, lub - II0 – III0 złośliwości, lub - ER (-) i PR (-), lub wiek poniżej 35 lat | ||
|---|---|---|---|---|
| ER (+) lub PR (+) | ER (-) lub PR (-) | |||
| Przed menopauzą | Nie wymagają leczenia systemowego | TAM +/- CHTH | CHTH+TAM | CHTH |
| Po menopauzie | TAM | TAM | CHTH | |
| Podeszły wiek | TAM | TAM | TAM | |
W przypadku obecności przerzutów do węzłów chłonnych:
| ER (+) lub PR (+) | ER (-) i PR (-) | |
|---|---|---|
| Przed menopauzą | CHTH + TAM | CHTH |
| Po menopauzie | TAM | CHTH |
| Podeszły wiek | TAM | TAM |
Leczenie systemowe należy rozpocząć w ciągu 4 – 6 tygodni od daty zabiegu radykalnego (jeśli zabieg dwuetapowy w przypadku leczenia oszczędzającego – od daty limfadenektomii).
| Podtyp raka piersi | Charakterystyka | Zalecany sposób leczenia pozachirurgicznego |
|---|---|---|
| Luminalny A | ER (+) HER 2 (-) Ki-67 < 14% PR > 20% | Hormonoterapia |
| Luminalny B | Luminalny B - HER 2 (-) ER (+) PR (+) Ki-67 > 14% | Hormonoterapia + chemioterapia |
| Luminalny B HER 2 (+) ER (+) Każdy PR Każdy Ki-67 | Chemioterapia + leki blokujące aktywność receptora HER2 + hormonoterapia | |
| HER 2 nie-luminalny | HER 2 (+) ER (-) PR (-) | Chemioterapia + leki blokujące aktywność receptora HER2 |
| Basal-like (potrójnie ujemny) | HER 2 (-) ER (-) PR (-) | Chemioterapia |
Objaśnienia:
ER – receptor estrogenowy
PR – receptor progesteronowy
HER2 – human epidermal growth factor receptor 2 (receptor ludzkiego czynnika wzrostu naskórka)
Ki-67 – marker proliferacji komórkowej
7.8 Schematy leczenia systemowego - Chemioterapia
Zastosowanie chemioterapii w przypadku raka piersi
Chemioterapia w leczeniu raka piersi może występować jako leczenie neoadjuwantowe (chemioterapia wspomagająca leczenie chirurgiczne, stosowana przed zabiegiem chirurgicznym), jako leczenie adjuwantowe (chemioterapia realizowana po leczeniu chirurgicznym w celu uzupełnienia zabiegu operacyjnego) oraz jako leczenie indukcyjne (w celu zmniejszenia masy guza i ograniczenia miejscowego zaawansowania choroby, co umożliwia następnie wykonanie zabiegu operacyjnego).
Chemioterapia ma zastosowanie w sytuacji, gdy guz nowotworowy rośnie bardzo szybko lub gdy szybko pojawiają się przerzuty odległe – wskazane jest wówczas uzyskanie jak najszybszej odpowiedzi ogólnoustrojowej na leczenie. Także u chorych, u których nie stwierdza się obecności receptorów estrogenowych i progesteronowych (czyli guz nie jest potencjalnie wrażliwy na hormonoterapię) chemioterapia jest systemowym leczeniem z wyboru.
W przypadku konieczności stosowania leczenia systemowego u kobiet młodych, przed menopauzą, chemioterapia także jest przede wszystkim brana pod uwagę jako sposób leczenia raka piersi, zarówno w skojarzeniu z zabiegiem operacyjnym, jak i sama (w tym przypadku głównie jako leczenie paliatywne.
Schematy chemioterapii stosowane w leczeniu raka piersi:
CMF (1)
Cyclophosphamid – 100 mg/m2 p.o. d. 1 – 14
Methotrexat – 40 mg/m2 i.v. d. 1 i 8
5-Fluorouracyl – 600 mg/m2 i.v. d. 1 i 8
Należy podać 6 kursów w ciągu 6 miesięcy
CMF (2)
Cyclophosphamid – 600 mg/m2 i.v. d. 1 i 8
Methotrexat – 40 mg/m2 i.v. d. 1 i 8
5-Fluorouracyl – 600 mg/m2 i.v. d. 1 i 8
Odstęp między cyklami wynosi 4 tygodnie
CMFVP
Cyklofosfamid 100 mg/m2 p.o. d 1 – 14
Metotrexat 40 mg/m2 i.v. d 1 i 8
5-Fluorouracyl 500 mg/m2 i.v. d 1 i 8
Winkrystyna 1 mg/m2 i.v. d 1 i 8
Prednizon 40 mg/m2 p.o. d. 1 – 14
Odstęp między cyklami wynosi 4 tygodnie
CAF (1)
Cyklofosfamid 100 mg/m2 p.o. d. 1 – 14
Doksorubicyna 25 mg/m2 i.v. d. 1 i 8
5-Fluorouracyl 500 mg/m2 i.v. d. 1 i 8
Odstęp pomiędzy cyklami wynosi 4 tygodnie
CAF (2)
Cyklofosfamid 500 mg/m2 i.v. d. 1
Doksorubicyna 50 mg/m2 i.v. d. 1
5-Fluorouracyl 500 mg/m2 i.v. d. 1
Odstęp pomiędzy cyklami wynosi 3 tygodnie
AC
Doksorubicyna 60 mg/m2 i.v. d. 1
Cyklofosfamid 600 mg/m2 i.v. d. 1
Odstęp pomiędzy cyklami wynosi 3 tygodnie
Port dożylny. Alternatywa dla standardowego dożylnego podawania leków - czytaj więcej
Hormonoterapia
Tamoxifen 20 mg/dobę przez okres 5 lat
Tamoxifen nie jest stosowany razem z chemioterapią. Należy pamiętać o możliwych skutkach ubocznych działania tamoxifenu, jak powikłania zatorowo-zakrzepowe i osteoporoza. Osteoporoza występuje częściej przy stosowaniu innych leków hormonalních, takich jak inhibitory aromatazy. Przy stosowaniu hormonoterapii zalecane jest stosowanie preparatów zawierających wapń oraz wit. D. Zalecane jest także wykonywanie okresowych badań oceniających gęstość mineralną kości.
Test diagnostyczny MammaPrint:
MammaPrint jest testem diagnostycznym do oceny ryzyka wystąpienia przerzutów raka piersi do innych części ciała. Pomaga lekarzom w określeniu, czy poszczególni pacjenci odniosą korzyść z chemioterapii. MammaPrint jest częścią pakietu Symphony Suite wspomagającego decyzje terapeutyczne w leczeniu raka piersi, wprowadzonego do obrotu przez firmę Agendia. MammaPrint jest oparty na 70-genowym „podpisie genetycznym” raka piersi. Wykorzystuje on tkanki zatopione w parafinie lub świeże do analizy z użyciem mikromacierzy.
Po takim badaniu diagnostycznym lekarz może zdecydować o zastosowaniu najbardziej odpowiedniego schematu leczenia.
W lutym 2007 r. organ U.S. Food and Drug Administration (FDA) zatwierdził test MammaPrint do stosowania w Stanach Zjednoczonych u pacjentek w każdym wieku z rakiem piersi z ujemnym odczynem w węzłach chłonnych oraz z ujemnym lub dodatnim odczynem ER, których guz jest mniejszy niż 5 cm.
Badania kontrolne
Badania kontrolne po leczeniu radykalnym:
- co 3 miesiące przez pierwsze 2 lata
- co 6 miesięcy w czasie 2 – 5 lat po zabiegu
- raz na rok po 5-latach od zabiegu
Badania dodatkowe:
- u kobiet po amputacji radykalnej – mammografia raz na rok
- u kobiet po BCT – mammografia po 6 miesiącach i następnie raz na rok. Scyntymammografia po 6 mies. (jeśli badanie dostępne)
- RTG płuc – raz na rok
- badanie ginekologiczne + cytologia – raz na rok
Czy możliwe jest zajście w ciążę po leczeniu raka piersi?
W przypadku kobiet otrzymujących chemioterapię, zajście w ciążę jest możliwe po całkowitym zakończeniu leczenia i okresie obserwacji, wystarczającym na powrót prawidłowej funkcji jajników. W każdym przypadku planowania zajścia w ciążę przed rozpoczęciem leczenia należy tę kwestię omówić z onkologiem.
Opracowanie:
dr hab. n. med. Tomasz Jastrzębski, prof. ndzw. GUMed
Klinika Chirurgii Onkologicznej
Uniwersyteckie Centrum Kliniczne w Gdańsku